
- •Термодинамика. Лекция 2.
- •Расчет основных термодинамических величин δu, q, w.
- •1. Термодинамические характеристические функции (функции состояния).
- •1.1. Внутренняя энергия и ее основное свойство.
- •1.2. Энтальпия.
- •1.3. Свободная энергия и свободная энтальпия.
- •1.4. Дифференциальные соотношения термодинамики.
- •2. Внешние воздействия (функции процесса).
- •2.1. Расчет количества теплоты и теплоемкости.
- •Расчет количества теплоты и энтропия.
- •3. Термодинамические свойства веществ.
- •3.1. Свойства веществ и расчет внутренней энергии и энтальпии.
- •3.1.1. Идеальный газ.
- •3.2. Внутренняя энергия идеального газа (свойства и расчет).
- •3.3. Свойства веществ и расчет изменения энтропии.
- •4. Расчет количества работы.
- •4.1. Введение.
- •4.2. Расчет работы в технической термодинамике.
- •5. Основы графического метода в термодинамике.
2.1. Расчет количества теплоты и теплоемкости.
Потребность в расчетах количества теплоты в научной и инженерной практике появилась задолго до «рождения» термодинамики. Эта потребность стимулировала появление специальной науки – калориметрии, в которой центральным понятием является понятие теплоемкости. Исторически термин «емкость теплоты» перешел в «теплоемкость», которая различается по многим характеристикам.
Определение. Истинной теплоемкостью вещества называется отношение бесконечно малого количества теплоты к бесконечно малому изменению температуры:
![]() Дж/К (2.9)
Дж/К (2.9)
Смысл слова «истинная» состоит в том, что бесконечно малое приращение температуры dT берется от какой-то температуры Т. Поэтому истинная теплоемкость является функцией от самой температуры (параметр, влияющий на свойства вещества).
Наверное, понятно, что при одном и том же изменении температуры dT элементарное количество теплоты dQ и, следовательно, теплоемкость при таком изменении зависят от количественной меры вещества. В химической технологии – это число молей (кмоль), в технике и быту количество вещества определяют или массой m (кг), или объемом V0 при нормальных условиях (нм3)(в химии р0 = 760 мм. рт. ст, Т0 = 298К). Поэтому истинную теплоемкость относят (уделяют) на одну из этих мер. Соответственно, получается удельная истинная теплоемкость массовая, мольная и объемная. Их обозначения (не стандартизованы) и размерность следующие: [c] = Дж/кгК, [μc] = Дж/кмольК, [c΄] = Дж/нм3К.
Определение. Средней теплоемкостью называется
 , ΔT = t2
– t1 (2.10)
, ΔT = t2
– t1 (2.10)
Индекс «m» внизу у значка теплоемкости присвоен для обозначения слова «средний» (от английского слова middle или немецкого mittel). По существу, средняя теплоемкость – это средне интегральная величина истинной теплоемкости.
Иными словами, средняя теплоемкость вещества в каком-то интервале температуры – это количество теплоты, которое надо подвести (отвести) к (от) рабочему телу, чтобы изменить его температуру на 1 градус.
Так как удельное (полное) количество
теплоты q (Q) является функцией процесса,
то в калориметрии пришлось отдельно
рассматривать теплоемкости по процессам:
изохорную (v = const) и изобарную (p = const), так
как эти процессы наиболее часто
применяются на практике (емкости, трубы,
аппараты и т.д.) Обозначение этих
теплоемкостей (калорических величин)
следующее: ср, сv
или
![]() ,
,
![]() для истинных и средних теплоемкостей
соответственно.
для истинных и средних теплоемкостей
соответственно.
В итоге выстраивается обширная классификация теплоемкостей: по интервалам температур на истинные и средние, по количествам вещества на массовые, мольные и объемные; по свойствам самих веществ; и, наконец, по множеству видов процессов, среди которых чаще всего встречаются изохорный и изобарный. Это численное и содержательное обилие теплоемкостей требует внимательного отношения к символам и размерностям рассмотренной калорической величины. Мы рекомендуем студентам в своей учебной работе всякий раз четко понимать и обозначать, о какой же теплоемкости в их расчетах идет речь (а их оказалось 7 видов без учета свойств веществ, а с ними и номенклатуры теплоемкостей). При любых расчетах всегда надо указывать размерность и номенклатуру (т.е. название) используемой теплоемкости.
Тогда удельное количество теплоты находится как:
q =
![]() ΔT,
Дж/кг, q = μ
ΔT,
Дж/кг, q = μ![]() ΔT, Дж/кмоль, и q
=
ΔT, Дж/кмоль, и q
=
![]() ΔT,
Дж/нм3.
ΔT,
Дж/нм3.
А полное количество теплоты находится как:
Q = mq = m ΔT, Q = nq = n μ ΔT, Q = V0q = V0 ΔT , Дж.
Соотношение теплоемкостей, отнесенных к разным количествам вещества следующее:
μс = μ∙с = с΄∙22,4 кДж/кмольК. (2.11)
Примечание: конкретное освоение и расчет теплоемкостей рассматривается на лабораторной работе №2 «Определение объемной теплоемкости воздуха при постоянном давлении».
. Существуют многочисленные табличные данные в справочной литературе по этим величинам теплоемкостей. Но для прикидочных расчетов, в которых нет особых требований к точности результата, полезно пользоваться постоянными величинами теплоемкостей, которые приводятся в таблице ниже.
Таблица приближенных значений мольных
теплоемкостей газов при невысоких температурах.
-
Газ
μcv, кДж/кмоль К
Одноатомный
12,6
Двухатомный
20,9
Трех и более атомный
29,1
Окончательно: теплоемкость, как калорическая (тепловая) величина, не относится к категории функций состояния и тем более к параметрам состояния. Строго говоря, понятие теплоемкости чуждо термодинамике, так как количество термического воздействия внешней среды на систему можно рассчитать и без теплоемкости как dq = Tds. Тем не менее обилие справочного материала по теплоемкости для большого числа веществ и привычка к этой калорической характеристике сделали ее широко употребительной в термодинамических и других физико-химических расчетах.
Теперь с помощью простых физических соображений покажем, что изобарная теплоемкость любого вещества всегда больше изохорной (ср > cv).
Сначала проведем мысленный эксперимент, как бы используя экспериментальную установку на рис.2.5.
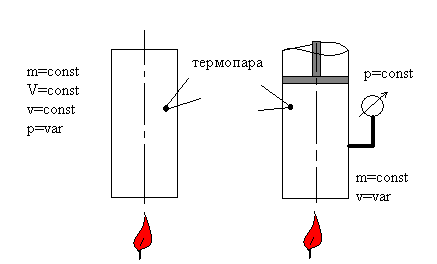
Рис.2.5. Схема двух экспериментов.
Измеряемые величины: температура Т с помощью термопар,
давление р с помощью манометра, количество теплоты q.
В первом случае (слева) просто нагреваем баллон с газом, во втором – нагреваем и поддерживаем постоянное давление в сосуде, позволяя газу расширяться. Зададимся вопросом: «В каком случае необходимо подвести больше теплоты, если начальная температура Т и ее изменение ΔТ в обоих случаях одинаковы?». Или иначе: «Какая теплоемкость больше: ср или сv?».
Ответ основывается на принципиальном различии экспериментов: слева термодинамическая система деформационно изолирована от внешней среды, т.е. не может совершить работу dw = pdv, а справа – может. И газ по-прежнему нагревается на ΔТ от подведенной теплоты qv = cvΔT, а во втором случае qp = qv(ΔT) + q(w) ≡ cpΔT. Поэтому ответ на поставленный вопрос: ср > сv.
