
- •Термодинамика. Лекция 2.
- •Расчет основных термодинамических величин δu, q, w.
- •1. Термодинамические характеристические функции (функции состояния).
- •1.1. Внутренняя энергия и ее основное свойство.
- •1.2. Энтальпия.
- •1.3. Свободная энергия и свободная энтальпия.
- •1.4. Дифференциальные соотношения термодинамики.
- •2. Внешние воздействия (функции процесса).
- •2.1. Расчет количества теплоты и теплоемкости.
- •Расчет количества теплоты и энтропия.
- •3. Термодинамические свойства веществ.
- •3.1. Свойства веществ и расчет внутренней энергии и энтальпии.
- •3.1.1. Идеальный газ.
- •3.2. Внутренняя энергия идеального газа (свойства и расчет).
- •3.3. Свойства веществ и расчет изменения энтропии.
- •4. Расчет количества работы.
- •4.1. Введение.
- •4.2. Расчет работы в технической термодинамике.
- •5. Основы графического метода в термодинамике.
1.4. Дифференциальные соотношения термодинамики.
Каждое из четырех дифференциальных выражений может служить для вывода связи параметров состояния. Эти связи в термодинамике называются «Уравнениями Максвелла» или дифференциальными соотношениями. Действительно, если u = u(s,v), то
du = (∂u/∂s)vds + (∂u/∂v)sdv и du = Tds – pdv.
Отсюда: T = (∂u/∂s)v и -p = (∂u/∂v)s.
В математическом анализе существует теорема о равенстве вторых смешанных производных. Тогда
∂2u/∂s∂v = ∂2u/∂v∂s → (∂T/∂v)s = -(∂p/∂s)v . (2.8)
Это уравнение связи четырех термодинамических параметров в технике или в природе и характеризует количественно равенство двух совершенно разных физических эффектов: изменение температуры Т при изменении удельного объема v в адиабатно-изоэнтропийном процессе численно такое же, как изменение давления p при изменении энтропии s (т.е. при равновесном теплообмене) в изохорном процессе. Получить такую взаимосвязь иным, т. е. не термодинамическим, способом в принципе невозможно.
Предлагаем студентам для тренировки самостоятельно вывести еще 3 дифференциальных соотношения из выражений для dh, df, dg.
По существу, единственная содержательная суть термодинамики – это первый закон термодинамики + диффсоотношения! А где она применяется (техника, химия, электро-магнитные процессы, коммерческие фирмы, коммерческие банки и т.д.) – дело прикладников термодинамики.
2. Внешние воздействия (функции процесса).
Если справедливо (2.3), то для замкнутого контура процессов (цикла)
![]() ,
,
![]()
![]()
т.е. сумма внешних теплот за цикл равна сумме внешних работ, а это может быть не только при нулевых слагаемых справа. Рассмотрим рис.2.3 и прейдем к процессам 1 – а – 2 и 2 – в – 1:
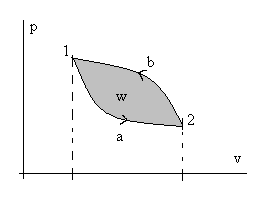
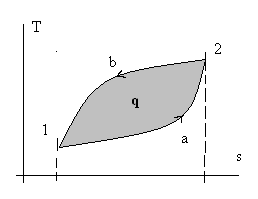
Рис. 2.3. Иллюстрация неполноты дифференциалов dq и dw.
![]() ;
;
![]() .
(2.8)
.
(2.8)
Здесь просто интеграл по замкнутому контуру разбили на два обычных интеграла: сначала интегрируем от точки 1 к точке 2 по траектории «а», потом обратно от точки 2 к точке 1 по траектории «в». И провели изменение направления интегрирования во втором интеграле. Из математического анализа известно, что геометрический смысл определенного интеграла от любой интегрируемой функции – это площадь под графиком этой функции. Обращаясь снова к рис. 2.3, видно, что интеграл по замкнутому контуру от количеств внешних воздействий dq и dw равен площади замкнутого контура (цикла) в соответствующих координатах. Наверное, понятно, что эта площадь сильно зависит не только от координат точки 1 и точки 2, но и от вида (формы) самих траекторий перехода из т. 1 в т.2 и обратно. Особенно это наглядно видно на рис.2.4.
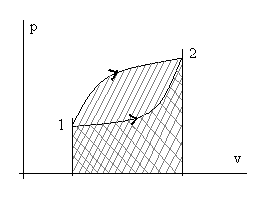
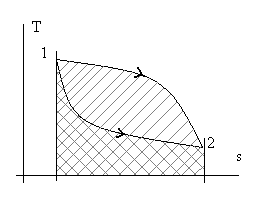
Рис. 2.4. Иллюстрация зависимости количества теплоты q и работы w
от траектории пути процесса перехода из состояния т.1 в состояние т. 2.
Разная штриховка соответствует разным траекториям (процессам).
Из рассмотренного следует, что интеграл ∫dw (сумма элементарных количеств работы) и, аналогично, ∫dq (сумма элементарных количеств теплоты) зависят от вида траектории при неизменных начальных и конечных состояниях процесса.
Определение. Величины (функции), изменение которых зависят не только от состояния (параметров) начала и конца процесса, но и еще от траектории, называются функциями процесса.
Заключение: внутренняя энергия u = u(s,v) является функцией состояния, а теплота q и работа w являются функциями процесса (как, впрочем, и любое другое внешнее воздействие – электрическое, химическое, массообменное и т.д.).
Замечание. В различных учебниках, монографиях, учебных пособиях по технической термодинамике подчас вводят специальное обозначение для приращений теплоты и работы в виде δq и δw вместо dq и dw, как в этих лекциях, как бы подчеркивая, что это элементарные приращения, а не полные дифференциалы.
.
