
- •Основы химической кинетики
- •Основы химической кинетики
- •Введение
- •1. Основные понятия химической кинетики
- •2. Скорость химических реакций
- •2.1. Гомогенные химические реакции
- •2.2. Зависимость скорости гомогенной химической реакции от концентрации реагирующих веществ
- •2.3. Графический метод определения констант дифференциального кинетического уравнения
- •2.4. Зависимость концентрации реагирующих веществ от времени для реакции первого порядка. Интегральное кинетическое уравнение
- •2.5. Скорость гетерогенной химической реакции
- •2.6. Зависимость скорости химической реакции от температуры
- •2.6.1. Уравнение Аррениуса
- •2.6.2. Энергия активации
- •Распределение молекул по энергиям
- •2.6.4. Энтропия активации. Стерический фактор
- •2.6.5. Применение уравнения Аррениуса
- •3. Каталитические реакции
- •3.1. Основные понятия
- •3.2. Сущность каталитического действия
- •3.3. Гомогенный катализ
- •3.4. Гетерогенный катализ
- •4. Химическое равновесие
- •4.1. Состояние равновесия
- •4.2. Константа равновесия
- •4.3. Расчет равновесного состава продуктов химической реакции
- •4.4. Смещение химического равновесия. Принцип Ле Шателье
- •4.4.1. Изменение концентраций
- •4.4.2. Изменение давления
- •4.4.3. Влияние температуры
- •5. Цепные реакции
- •5.1. Неразветвленные цепные реакции
- •5.2. Разветвленные цепные реакции
- •6. Индивидуальные задания для самостоятельной подготовки студентов
- •6.1. Примеры решения типовых задач
- •6.2. Задачи для домашнего задания
- •6.3. Варианты домашних заданий
- •6.4. Варианты дополнительных домашних заданий
- •7. Экспериментальная часть Лабораторная работа «Определение дифференциального кинетического уравнения»
- •Выполнение работы
- •Вопросы для самоконтроля
- •Литература
- •Редактор н.П. Лапина
3. Каталитические реакции
3.1. Основные понятия
Катализаторы - вещества, изменяющие скорость реакции и остающиеся к концу реакции химически неизменными.
Явление изменения скорости реакции под действием таких веществ называется катализом.
Реакции, протекающие под действием катализаторов, называются каталитическими реакциями.
Реакции, в которых катализатором является продукт реакции, называются автокаталитическими.
Важным свойством катализаторов является селективность (избирательность) их действия, проявляющаяся в увеличении скорости только определенной из нескольких возможных реакций.
Вещества, малые примеси которых могут сильно снижать или полностью подавлять активность катализатора, называются каталитическими ядами.
Промоторы – вещества, которые увеличивают активность катализаторов, хотя сами таковыми не являются.
По фазовому принципу различают гомогенный и гетерогенный катализ.
3.2. Сущность каталитического действия
Катализ обусловлен промежуточным химическим взаимодействием реагирующих веществ с катализатором, в результате которого открывается новый реакционный путь. Ускорение процессов с помощью катализаторов достигается за счет того, что появляются новые механизмы, при которых медленные стадии заменяются более быстрыми.
Реакция превращения веществ А и В в вещество АВ с участием катализатора К осуществляется по следующей схеме:
A + K AK
АК + В АВ + К
-------------------------------------
А + В АВ.
Независимо от механизма действия роль катализатора с точки зрения энергетики реакции сводится, как показано на рис. 9, к снижению энергии активации (Еакат Еа ), за счет чего увеличивается константа скорости реакции.
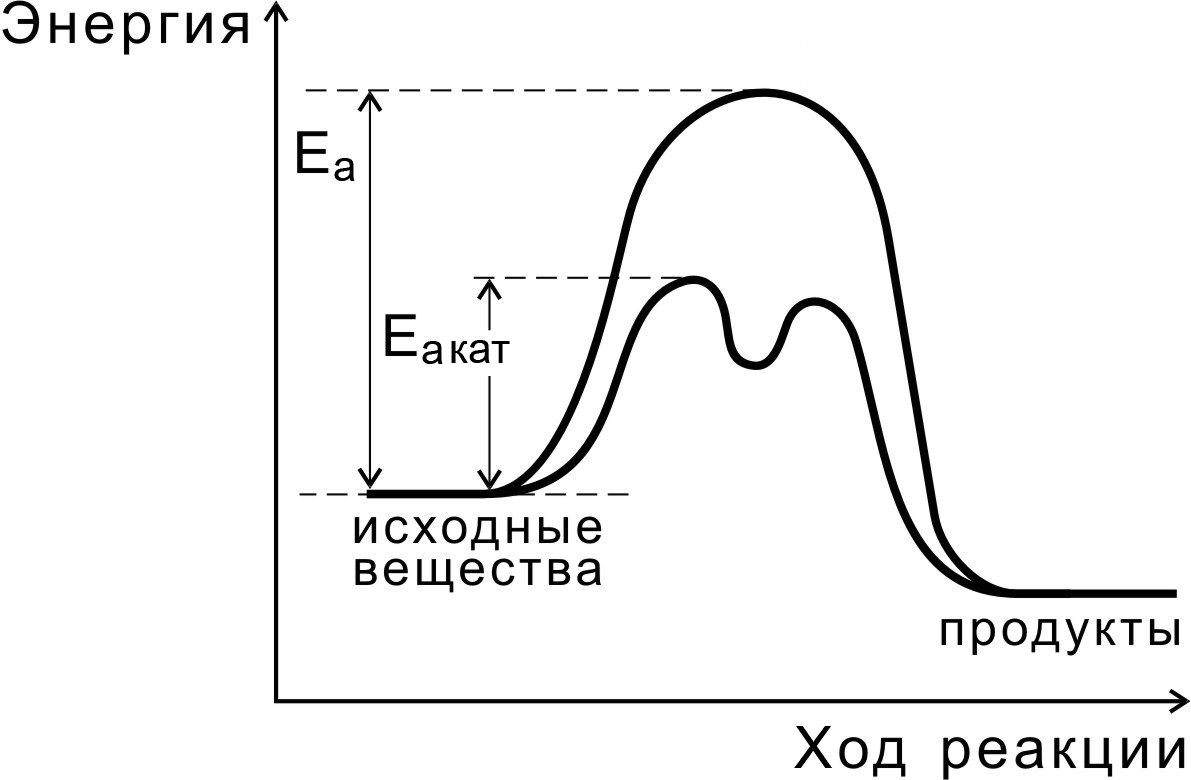
Рис.9. Реакция с участием катализатора
Катализатор может также способствовать необходимой для взаимодействия молекул ориентации.
Катализатор не влияет на константу химического равновесия и не смещает положение химического равновесия.
Энергия активации прямой и обратной реакций при введении катализатора уменьшается на одинаковую величину.
Катализатор ускоряет прямую и обратную реакции, т.е. сокращает время достижения равновесия при подходе к нему как со стороны исходных веществ, так и со стороны продуктов.
3.3. Гомогенный катализ
Гомогенным называют катализ, при котором катализатор и реагирующие вещества находятся в одной фазе (газовой или жидкой).
Примером гомогенного газофазного каталитического процесса может служить окисление диоксида серы SO2 до триоксида SO3. Без катализатора диоксид серы очень медленно окисляется кислородом. При производстве серной кислоты камерным способом процесс окисления диоксида серы до триоксида катализируется оксидом азота (II), который открывает для реакции новый путь, не включающий медленной стадии взаимодействия диоксида серы с молекулярным кислородом
2
SO2
(г)
+ О2
(г)
![]() 2
SO3
(г).
2
SO3
(г).
Катализатор NO вступает в реакцию с кислородом О2 , образуя промежуточный продукт NO2,
2NO (г) + O2 (г) 2NO2(г) .
NO2 затем реагирует с SO2 по реакции
2SO2 (г) + 2NO2 (г) = 2SO3 (г) + 2NO (г),
в результате которой получается конечный продукт и выделяется катализатор в химически неизменном виде и первоначальном количестве.
К преимуществам гомогенного катализа можно отнести высокую эффективность действия катализаторов, так как реакция идет во всем объеме сосуда. Но практическое выделение продуктов из реакционной смеси может быть затруднено.
