
- •Основы химической кинетики
- •Основы химической кинетики
- •Введение
- •1. Основные понятия химической кинетики
- •2. Скорость химических реакций
- •2.1. Гомогенные химические реакции
- •2.2. Зависимость скорости гомогенной химической реакции от концентрации реагирующих веществ
- •2.3. Графический метод определения констант дифференциального кинетического уравнения
- •2.4. Зависимость концентрации реагирующих веществ от времени для реакции первого порядка. Интегральное кинетическое уравнение
- •2.5. Скорость гетерогенной химической реакции
- •2.6. Зависимость скорости химической реакции от температуры
- •2.6.1. Уравнение Аррениуса
- •2.6.2. Энергия активации
- •Распределение молекул по энергиям
- •2.6.4. Энтропия активации. Стерический фактор
- •2.6.5. Применение уравнения Аррениуса
- •3. Каталитические реакции
- •3.1. Основные понятия
- •3.2. Сущность каталитического действия
- •3.3. Гомогенный катализ
- •3.4. Гетерогенный катализ
- •4. Химическое равновесие
- •4.1. Состояние равновесия
- •4.2. Константа равновесия
- •4.3. Расчет равновесного состава продуктов химической реакции
- •4.4. Смещение химического равновесия. Принцип Ле Шателье
- •4.4.1. Изменение концентраций
- •4.4.2. Изменение давления
- •4.4.3. Влияние температуры
- •5. Цепные реакции
- •5.1. Неразветвленные цепные реакции
- •5.2. Разветвленные цепные реакции
- •6. Индивидуальные задания для самостоятельной подготовки студентов
- •6.1. Примеры решения типовых задач
- •6.2. Задачи для домашнего задания
- •6.3. Варианты домашних заданий
- •6.4. Варианты дополнительных домашних заданий
- •7. Экспериментальная часть Лабораторная работа «Определение дифференциального кинетического уравнения»
- •Выполнение работы
- •Вопросы для самоконтроля
- •Литература
- •Редактор н.П. Лапина
2.3. Графический метод определения констант дифференциального кинетического уравнения
Определим константы дифференциального кинетического уравнения для следующей реакции:
аА + bB → продукты.
Зависимость скорости от концентраций выражается уравнением (2.3)
![]() .
.
Прологарифмируем это выражение
|
(2.4) |
Так как величины k, n и m для рассматриваемой реакции (при T = const) являются постоянными и не зависят от концентрации реагентов, то для их нахождения достаточно определить зависимость скорости реакции от концентрации одного из реагентов при фиксированной концентрации другого реагента.
Пусть
в трех опытах концентрация вещества А
будет
постоянной и равной [A]0,
тогда в уравнении (2.4) сумма (![]() )
будет тоже величиной постоянной,
обозначим ее
)
будет тоже величиной постоянной,
обозначим ее
![]() .
.
Тогда уравнение (2.4) можно переписать как
|
(2.5) |
Зависимость
(2.5) представляет собой в координатах
ln[B]
—
![]() уравнение прямой линии, тангенс угла
наклона которой к оси абсцисс численно
равен порядку реакции по веществу В.
уравнение прямой линии, тангенс угла
наклона которой к оси абсцисс численно
равен порядку реакции по веществу В.
По экспериментальным данным строят график зависимости от ln[B] (рис. 3) и находят порядок реакции по веществу B
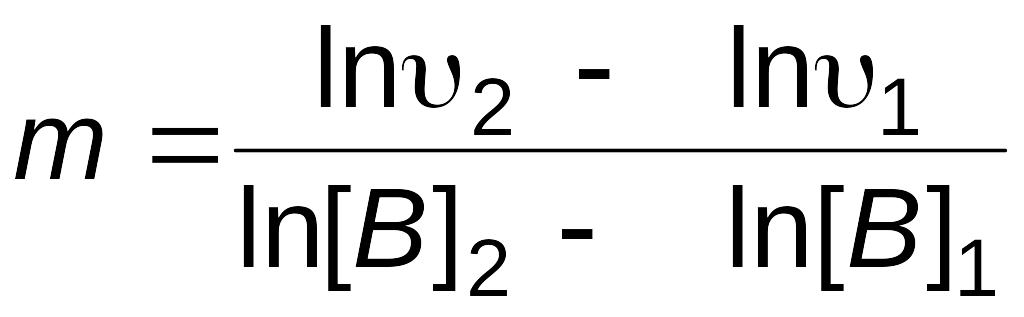 .
.
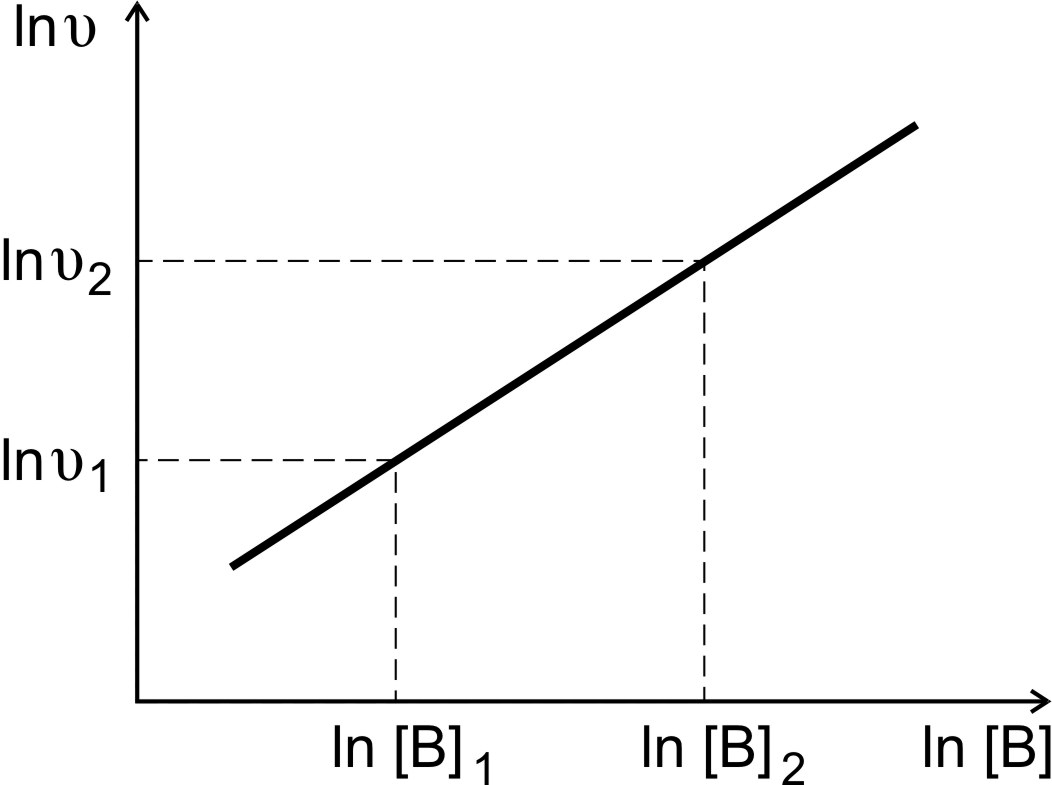
Рис.3. Определение порядка реакции по веществу В
В последующих опытах определяют скорость реакции при различных исходных концентрациях вещества А и постоянной концентрации [B]0. Находят порядок реакции по веществу А
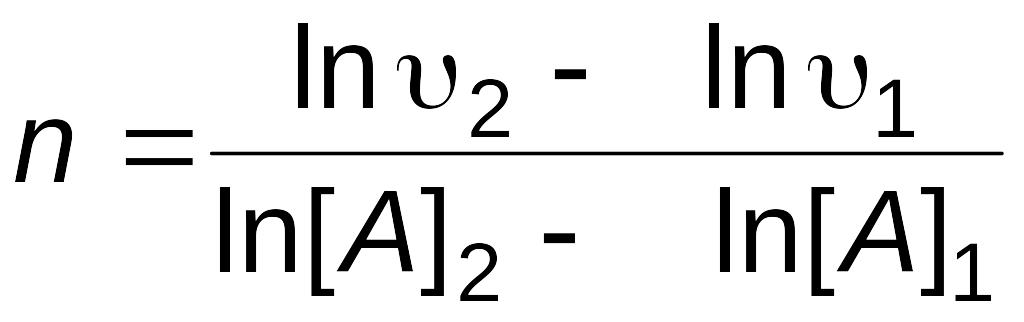 .
.
Из уравнения (2.3) с учетом найденных порядков реакции по веществам А и В рассчитывают константу скорости
 ,
,
где
![]() ,
[A]i,
[B]i
- экспериментальные данные, относящиеся
к одному опыту.
,
[A]i,
[B]i
- экспериментальные данные, относящиеся
к одному опыту.
2.4. Зависимость концентрации реагирующих веществ от времени для реакции первого порядка. Интегральное кинетическое уравнение
На практике чаще всего интересует не само значение скорости химической реакции, а то, сколько вещества израсходовано или образовалось к определенному моменту времени после начала реакции.
Рассмотрим эту задачу на примере реакции первого порядка
А продукты.
Скорость такой реакции выражается следующим уравнением:
|
(2.6) |
В дифференциальном виде
|
(2.7) |
Перепишем это уравнение в следующем виде:
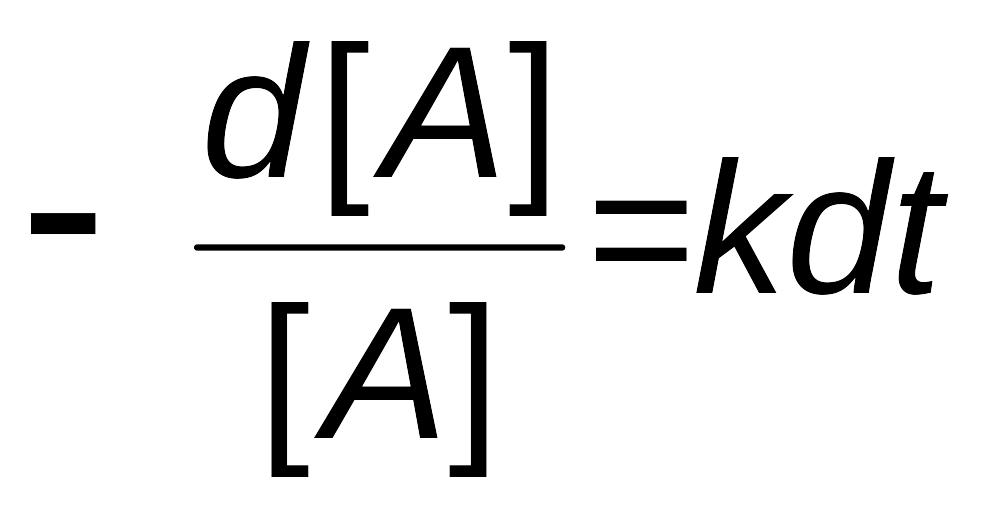 ,
,
и возьмем определенный интеграл от обеих частей уравнения от исходного состояния ([A]0, t0 = 0) до текущего момента ([A]t, t):
![]()
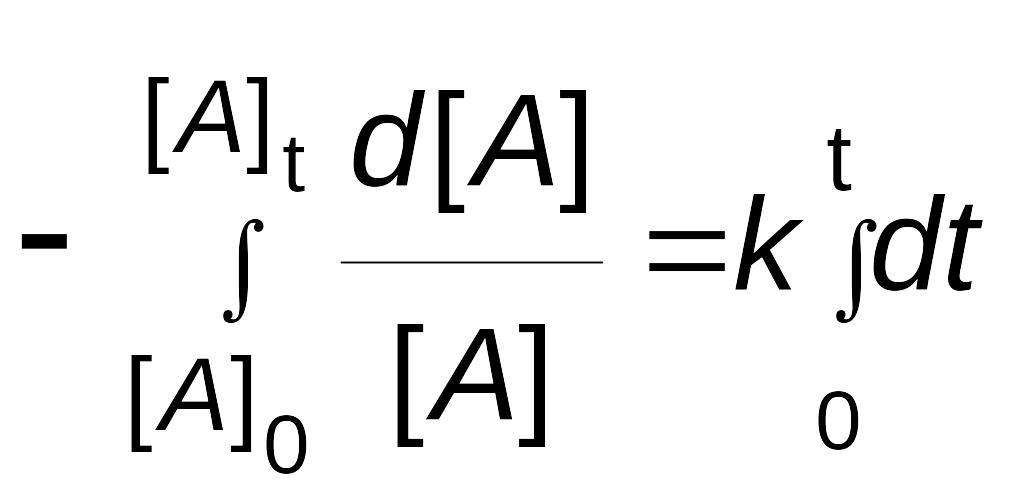 .
.
Решение этого уравнения приводит к следующей зависимости:
|
(2.8) |
или
|
(2.9) |
Соотношения (2.8) и (2.9) являются интегральными кинетическими уравнениями реакции первого порядка.
Зная исходную концентрацию вещества [A]0 и константу скорости реакции k, можно рассчитать концентрацию [A]t через любое время t после начала реакции.
Если же известны исходная концентрация [A]0 и концентрация реагирующего вещества [A]t через какое-то время t после начала реакции, то можно рассчитать константу скорости этой реакции
|
(2.10) |
Часто
для характеристики скорости реакции
пользуются временем полупревращения
t1/2
(для реакции первого порядка чаще говорят
«период полураспада»). t1/2
-
это время, за которое прореагирует
половина исходного вещества
![]() .
Тогда, исходя из уравнения (2.10), получим
следующие зависимости:
.
Тогда, исходя из уравнения (2.10), получим
следующие зависимости:
|
(2.11) |
|
|
|
(2.12) |

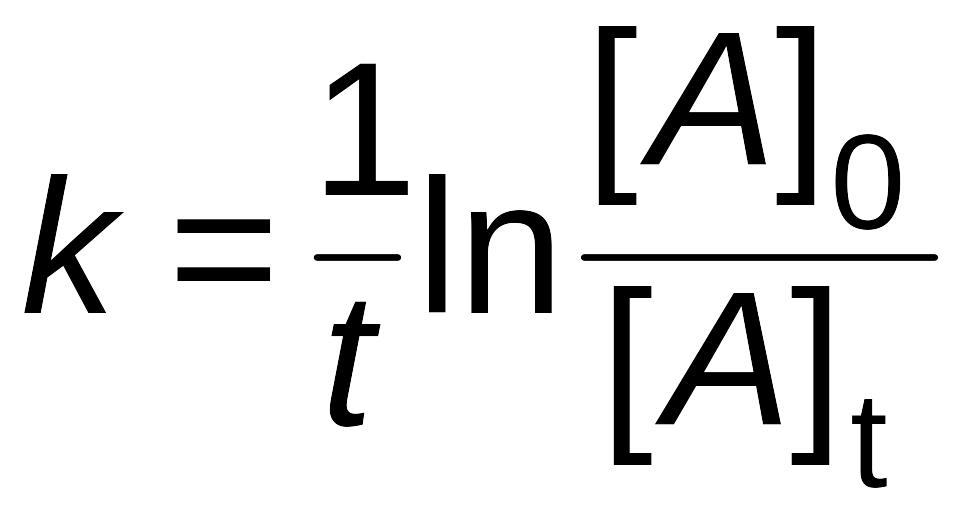 .
.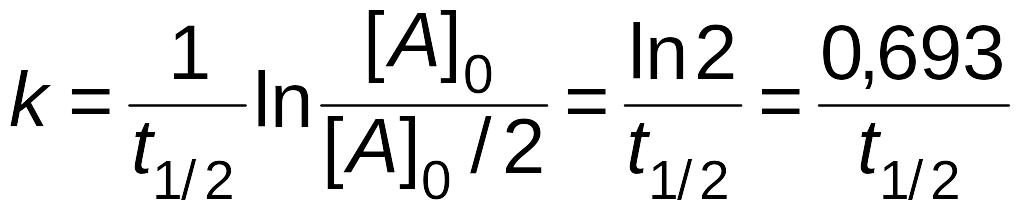 ;
;