Способы получения солей
Способы получения солей можно условно разбить на две группы:
1-й с п о с о б – получение солей из веществ, которые не являются солями;
2-й с п о с о б – получение солей из других солей.
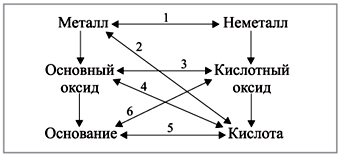
Реакции 1-го с п о с о б а основаны на том, что в реакцию вступают противоположные по свойствам вещества (рис. 4).
|
Рис. 4. Генетическая связь между неорганическими веществами разных классов |
Приведем конкретные примеры:
1) металл + неметалл:
Fe
+ S
![]() FeS;
FeS;
2) металл + кислота:
Fe + HCl FeCl2 + H2;
3) осно'вный оксид + кислотный оксид:
CaO + P2O5 Ca3(PO4)2;
4) осно'вный оксид + кислота:
MgO + HNO3 Mg(NO3)2 + H2O;
5) основание + кислота:
NaOH + H2SO4 Na2SO4 + H2O;
6) основание + кислотный оксид:
KOH + CO2 K2CO3 + H2O.
Задание 2.27. Расставьте коэффициенты в схемах реакций 1–6. Приведите свои примеры аналогичных реакций каждого типа.
Реакции 2-го с п о с о б а являются реакциями обмена или замещения. В каждой из таких реакций участвует соль, поэтому 2-й способ получения солей можно рассматривать как химические свойства солей.
• Более активный металл вытесняет менее активный из растворов его солей:
Fe + CuSO4 = FeSO4 + Cu.
Обратный процесс не идет:
![]()
Активность металлов можно определять по ряду напряжений. Любой металл в этом ряду активнее всех металлов, стоящих правее него.
• Сильная кислота вытесняет более слабую кислоту из ее соли:
2HNO3 + CaCO3 = Ca(NO3)2 + H2CO3.
• Щелочь, реагируя с солью, образует новое основание и новую соль:
3KОН + АlС13 = А1(OH)3 + 3KСl.
Такая реакция происходит, если оба исходных вещества растворимы, а хотя бы одно из полученных веществ нерастворимо.
• Соль, вступая в реакцию обмена с другой солью, образует две новые соли:
2AgNO3 + BaCl2 = Ba(NO3)2 + 2AgCl .
Эта реакция также происходит, если оба исходных вещества растворимы, а хотя бы одно из полученных веществ – нерастворимо.
Например, реакция
![]()
невозможна, т.к. обе полученные соли растворимы.
Другой процесс:
СаСО3
+ NaCl
![]() (нет
реакции)
(нет
реакции)
невозможен потому, что СаСО3 (мел) нерастворим в воде.
Названия солей
Названия солей происходят от латинских названий химических элементов, которые входят в состав кислотных остатков (исключая кислород):
S – сульфур,
N – нитрогениум,
С – карбонеум,
Si – силициум.
Для солей одного элемента разного состава должны быть разные названия. Названия солей получают введением суффиксов:
для солей бескислородных кислот -ид;
для солей кислородсодержащих кислот -ит (меньшая валентность элемента)
или -ат (бoльшая валентность элемента).
Задание 2.28. Составьте названия солей, содержащих серу: K2S, K2SO3, K2SO4.
(При правильной работе должно получиться:
K2S – cульфид,
K2SO3 – cульфит,
K2SO4 – cульфат.)
Задание 2.29. Дополните табл. 5, составив химические формулы солей тех металлов, которые указаны в таблице.
Таблица 5
Названия солей
Кислота |
Соль |
Название |
HCl |
Al……. |
Хлорид |
HBr |
K……. |
Бромид |
HI |
Ca……. |
Йодид |
H2S |
Na……. |
Сульфид |
H2SO3 |
K……. |
Сульфит |
H2SO4 |
Al……. |
Сульфат |
HNO2 |
K……. |
Нитрит |
HNO3 |
Mg……. |
Нитрат |
H3PO4 |
Ca……. |
Фосфат |
H2CO3 |
K……. |
Карбонат |
H2SiO3 |
Na……. |
Силикат |
При составлении названий кислых солей используют частицу «гидро»: KНСО3 – гидрокарбонат калия.
При составлении названий оснoвных солей используют частицу «гидроксо»: АlOНСl2 – гидроксохлорид алюминия.
Задание 2.30. Назовите все соли, которые встречаются в тексте и уравнениях реакций этого раздела.
Задание 2.31. Составьте по три-четыре уравнения реакций получения:
а) бромида магния;
б) сульфата цинка.
Выводы по главе 2.4. Соли состоят из остатков веществ, которые проявляют противоположные свойства: кислотные и оснoвные, металлические и неметаллические.