
Свойства и способы получения нерастворимых в воде оснований
Среди нерастворимых в воде оснований следует выделить особую группу веществ – амфотерные гидроксиды. Их свойства будут рассмотрены ниже. Способы получения амфотерных оснований такие же, как и нерастворимых оснований.
Нерастворимые основания получают, действуя на раствор соли, в состав которой входит нужный атом металла, раствором щелочи:
CuSO4
+ 2NaOH = Cu(OH)2![]() + Na2SO4.
+ Na2SO4.
Попробуем определить, какие вещества нужно взять для того, чтобы получить гидроксид марганца(II). До реакции составные части нерастворимого основания Mn(OH)2 находились в составе растворимых веществ – соли марганца (например, MnCl2) и щелочи (например, KOH):
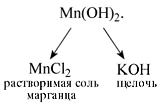
Уравнение реакции:
MnCl2 + 2KOH = Mn(OH)2 + 2KCl.
Задание 2.24. Напишите уравнения реакций, при помощи которых можно получить:
а) гидроксид железа(III); б) гидроксид железа(II).
Свойства нерастворимых в воде оснований во многом отличаются от свойств щелочей. Нерастворимые в воде основания не реагируют с растворами солей, а также с амфотерными и некоторыми кислотными оксидами.
• Нерастворимые основания реагируют с кислотами. При этом происходит растворение исходного нерастворимого вещества (осадка). Например:
![]()
Таким образом, подобные реакции возможны, если образуется растворимая соль.
• Нерастворимые основания разлагаются при нагревании. При этом чем меньше активность металла (см. ряд напряжений), тем легче разлагается основание на оксид и воду:
Свойства амфотерных гидроксидов
Амфотерные гидроксиды соответствуют амфотерным оксидам. Это означает, что в состав амфотерного гидроксида входит тот же атом металла и с той же валентностью, что и в состав амфотерного оксида:
![]()
Амфотерные вещества проявляют двойственные свойства, они реагируют и с кислотами, и с щелочами (при этом амфотерные гидроксиды растворяются):
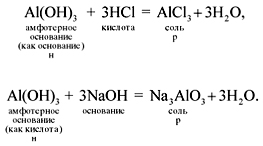
Если эта реакция происходит с растворами щелочей, то вместо вещества состава Na3AlO3 (или NaAlO2)* образуется сложное комплексное соединение: Na3[Al(OH)6] или Na[Al(OH)4].
Задание 2.25. Составьте уравнения реакций с кислотой и со щелочью следующих амфотерных гидроксидов: а) гидроксида цинка; б) гидроксида хрома(III).
Выводы по главе 2.3. Молекулы неорганических оснований содержат гидроксигруппы ОН.
Все неорганические основания, кроме NH4OH, содержат атомы металлов.
Основания делят на растворимые в воде (щелочи) и нерастворимые.
Растворы щелочей реагируют с кислотами (реакция нейтрализации), с кислотными и амфотерными оксидами, с растворами солей. Щелочи обнаруживаются индикаторами в щелочной («синей») области. Нерастворимые в воде основания не изменяют окраску индикатора, могут реагировать с некоторыми кислотами и кислотными оксидами. Термически неустойчивы.
2.4. Соли
Соль – это продукт реакции между кислотой и основанием.
В состав любой соли входит остаток основания (атом металла или группа NH4) и остаток кислоты (кислотный остаток). Например:
NH4NO3, K2CO3, CaHPO4, CuOHCl.
Задание 2.26. Для каждой из этих солей (см. выше) определите, где в ее молекуле остаток кислоты, а где – остаток основания. Определите валентности составных частей.
В состав некоторых солей входят атомы водорода или группы ОН. Такое различие подсказывает, что соли могут быть разных типов. Рассмотрим три вида солей.
Средние соли получаются, если кислота и основание полностью прореагировали:
![]()
Кислые соли получаются, если не все атомы водорода кислоты были замещены на атомы металла:
![]()
Кислотные остатки таких солей содержат атом водорода. Кислые соли могут проявлять некоторые свойства кислот. Например, они могут реагировать со щелочами:
![]()
Осно'вные соли образуются, если не все группы ОН основания замещаются на кислотный остаток:
![]()
Такие соли содержат гидроксигруппу ОН. Осно'вные соли могут проявлять некоторые свойства оснований. Например, они реагируют с кислотами:
![]()
Во многих примерах, которые иллюстрировали свойства оксидов, кислот и оснований, продуктами реакции были соли. Попробуем обобщить эти сведения и выяснить, в результате каких процессов можно получить соль заданного состава.
