
Значение постоянных валентностей некоторых элементов
Валентность |
Символы элементов |
I |
H, F, Ag, Na, K |
II |
O, Ca, Мg, Ba, Zn |
III |
Аl |
Для других атомов валентность** можно определить (вычислить) из химической формулы вещества. При этом нужно учитывать изложенное выше правило о химической связи. Например, определим валентность x марганца Mn по формуле вещества MnO2:
![]()
Общее число химических связей, образуемых одним и другим элементом (Mn и О), одинаково: x · 1 = 4; II · 2 = 4. Отсюда х = 4, т.е. в этой химической формуле марганец четырехвалентен.
П р а к т и ч е с к и е в ы в о д ы
1. Если один из атомов в молекуле одновалентен, то валентность второго атома равна числу атомов первого элемента (см. на индекс!):
![]()
2. Если число атомов в молекуле одинаково, то валентность первого атома равна валентности второго атома:
![]()
3. Если у одного из атомов индекс отсутствует, то его валентность равна произведению валентности второго атома на его индекс:
![]()
4. В остальных случаях ставьте валентности «крест-накрест», т.е. валентность одного элемента равна индексу другого элемента:
![]()
Задание 1.2. Определите валентности элементов в соединениях:
CO2, CO, Mn2O7, Cl2O, P2O3, AlP, Na2S, NH3, Mg3N2.
П о д с к а з к а. Сначала укажите валентность атомов, у которых она постоянная. Аналогично определяется валентность атомных групп ОН, РО4, SО4 и др.
Задание 1.3. Определите валентности атомных групп (в формулах подчеркнуты):
H3PO4, Ca(OH)2, Ca3(PO4)2, H2SO4, CuSO4.
(Обратите внимание! Одинаковые группы атомов имеют одинаковые валентности во всех соединениях.)
Зная валентности атома или группы атомов, можно составить формулу соединения. Для этого пользуются следующими правилами.
• Если валентности атомов одинаковы, то и число атомов одинаково, т.е. индексы не ставим:
![]()
• Если валентности кратны (обе делятся на одно и то же число), то число атомов элемента с меньшей валентностью определяем делением:
![]()
• В остальных случаях индексы определяют «крест-накрест»:
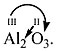
Задание 1.4. Составьте химические формулы соединений:

Вещества, состав которых отражают химические формулы, могут участвовать в химических процессах (реакциях). Графическая запись, соответствующая данной химической реакции, называется уравнением реакции. Например, при сгорании (взаимодействии с кислородом) угля происходит химическая реакция:
С + O2 = CO2.
Запись показывает, что один атом углерода С, соединяясь с одной молекулой кислорода O2, образует одну молекулу углекислого газа СО2. Число атомов каждого химического элемента до и после реакции должно быть одинаково. Это правило – следствие закона сохранения массы вещества. Закон сохранения массы: масса исходных веществ равна массе продуктов реакции.
Закон был открыт в XVIII в. М.В.Ломоносовым и, независимо от него, А.Л.Лавуазье.
Выполняя этот закон, необходимо в уравнениях химических реакций расставлять коэффициенты так, чтобы число атомов каждого химического элемента не изменялось в результате реакции. Например, при разложении бертолетовой соли KClO3 получается соль KСl и кислород О2:
KClO3
![]() KСl
+ О2.
KСl
+ О2.
Число атомов калия и хлора одинаково, а кислорода – разное. Уравняем их:

Теперь изменилось число атомов калия и хлора до реакции. Уравняем их:
![]()
Наконец, между правой и левой частями уравнения можно поставить знак равенства:
2KClO3 = 2KСl + 3О2.
Полученная запись показывает, что при разложении сложного вещества KClO3 получаются два новых вещества – сложное KСl и простое – кислород O2. Числа перед формулами веществ в уравнениях химических реакций называют коэффициентами.
При подборе коэффициентов необязательно считать отдельные атомы. Если в ходе реакции не изменился состав некоторых атомных групп, то можно учитывать число этих групп, считая их единым целым. Составим уравнение реакции веществ CaCl2 и Na3PO4:
CaCl2 + Na3PO4 ……………… .
П о с л е д о в а т е л ь н о с т ь д е й с т в и й
1) Определим валентность исходных атомов и группы PO4:
![]()
2) Напишем правую часть уравнения (пока без индексов, формулы веществ в скобках надо уточнить):
![]()
3) Составим химические формулы полученных веществ по валентностям составных частей:
![]()
4) Обратим внимание на состав самого сложного соединения Ca3(PO4)2 и уравняем число атомов кальция (их три) и число групп РО4 (их две):

5) Число атомов натрия и хлора до реакции теперь стало равным шести. Поставим соответствующий коэффициент в правую часть схемы перед формулой NaCl:
3CaCl2 + 2Na3PO4 = Ca3(PO4)2 + 6NaCl.
Пользуясь такой последовательностью, можно уравнять схемы многих химических реакций (за исключением более сложных окислительно-восстановительных реакций, см. главу 7).
Типы химических реакций. Химические реакции бывают разных типов. Основными являются четыре типа – соединение, разложение, замещение и обмен.
1. Реакции соединения – из двух и более веществ образуется одно вещество:
А + В АВ.
Например:
Са + Сl2 = CaCl2.
2. Реакции разложения – из одного вещества получаются два вещества или более:
АВ А + В.
Например:
Ca(HCO3)2 CaCO3 + CO2 + H2O.
3. Реакции замещения – реагируют простое и сложное вещества, образуются также простое и сложное вещества, причем простое вещество замещает часть атомов сложного вещества:
А + ВХ АХ + В.
Например:
Fe + CuSO4 = Cu + FeSO4.
4. Реакции обмена – здесь реагируют два сложных вещества и получаются два сложных вещества. В ходе реакции сложные вещества обмениваются своими составными частями:
АВ + XY АY + XВ.
Например:
Al(OH)3 + 3HCl = AlCl3 + 3H2O.
Существуют и другие типы химических реакций.
Задание 1.5. Расставьте коэффициенты в схемах реакций:
Na + Cl2 NaCl,
NaHCO3 Na2CO3 + CO2 + H2O,
Fe + AgNO3 Fe(NO3)2 + Ag,
Fe(OH)3 + HCl FeСl3 + H2O.
Задание 1.6. Расставьте коэффициенты и определите типы химических реакций:
Fe(OH)3 Fe2O3 + H2O,
Al + H2SO4 Al2(SO4)3 + H2,
HNO3 + Cu(OH)2 Cu(NO3)2 + H2O,
P + O2 P2O5.
Выводы по главе 1. Вещества состоят из молекул, молекулы состоят из атомов, атомы с одинаковым зарядом ядра относятся к одному и тому же химическому элементу.
Вещества бывают простые и сложные. Состав веществ показывают при помощи химических формул. Формулы веществ составляют, учитывая валентности составных частей. Запись химического процесса при помощи формул называется уравнением химической реакции. Химические реакции бывают разных типов: обмена, замещения, разложения, соединения и др.
