
- •2) Уменьшается (так как радиус атома элемента в группе увеличивается с ростом периода)
- •1) Открытой
- •Закон Гесса
- •Следствия из закона Гесса:
- •Помним, что стандартная теплота образования простых веществ равна нулю!!!!
- •Стандартная теплота сгорания оксидов также равна нулю!!!!
- •Первый закон термодинамики позволяет рассчитать энергетический баланс химического процесса.
- •Катионы электролита- золь заряжен отрицательно, т.К. Потенциалопределяющие ионы - со32- ( они в избытке и входят в состав ядра, значит коагуляцию будут вызывать катионы!
- •Пример:
- •Коагуляция смесью электролитов
- •Еще раз о скорости химических реакций
- •Идет реакция или нет?
- •В продуктах необходимо присутствие
- •1.Осадка
- •2. Газообразного вещества
- •3. Слабого электролита Пример
- •А сильные электролиты нужно запомнить!!!!!
- •Буферные системы Поддерживают постоянство рН в растворах.
- •Пример:
- •Пример:
- •До встречи на Выпускном вечере!!!!!!!!!!!
анионы электролита
Катионы электролита- золь заряжен отрицательно, т.К. Потенциалопределяющие ионы - со32- ( они в избытке и входят в состав ядра, значит коагуляцию будут вызывать катионы!
нейтральные молекулы
катионы и анионы одновременно
ни катионы, ни анионы
Пример:
Для золя иодида серебра, полученного по реакции
AgNO3(изб)+KI→AgI +KNO3, коагуляцию вызывают…
1) анионы электролита - золь заряжен положительно, т.к. потенциалопределяющие ионы – Ag+- ( они в избытке и входят в состав ядра, значит коагуляцию будут вызывать анионы!
2) нейтральные молекулы
3) катионы электролита
4 )
катионы и анионы одновременно
)
катионы и анионы одновременно
5) радикалы
Б) Правило заряда (валентности):
Пороги коагуляции обратно пропорциональны заряду иона-коагулянта в шестой степени:
П риготовить
золь с абсолютно одинаковыми свойствами
невозможно
риготовить
золь с абсолютно одинаковыми свойствами
невозможно
Н апример
для катионов К+, Ва2+,
А13+
, отношение порогов коагуляции их
хлоридов при действии на отрицательно
заряженный золь As2S3
соответственно равно:
апример
для катионов К+, Ва2+,
А13+
, отношение порогов коагуляции их
хлоридов при действии на отрицательно
заряженный золь As2S3
соответственно равно:
или, принимая порог коагуляции иона алюминия за единицу,
Т.е. пороги коагуляции отличаются для:
- однозарядных и двузарядных ионов примерно в 64 раза
- однозарядных и трехзарядных ионов примерно в 729 раз
- двузарядных и трехзарядных ионов примерно в 11 (729:64=11) раз
Пример:
Пороги коагуляции золя электролитами (одинаковой концентрации)
NaCl, BaCl2, LiNO3 равны соответственно 128 мМоль/л, 2мМоль/л, 125мМоль/л. Золь заряжен:
1. отрицательно - если золь заряжен положительно, то коагулирующее действие оказывали бы анионы, но у всех приведенных солей заряд анионов одинаков, значит и пороги коагуляции должны быть одинаковыми.
Но порог коагуляции для второй соли в 64 раза меньше, следовательно коагуляцию вызывал ион Ва2+ ( он по правилу знака в 64 раза эффективнее, чем однозарядный катион), значит золь заряжен отрицательно!
2. положительно
3. не имеет заряда
4. положительно при высоких температурах
5. положительно при низких температурах
Коагуляция смесью электролитов
a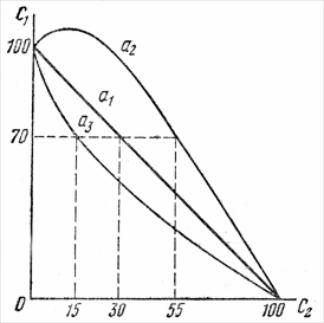 1
–
аддитивность-действие смеси аналогично
действию каждого из электролитов (70мл
CaCl2
+ 30мл NaCl=100мл)
1
–
аддитивность-действие смеси аналогично
действию каждого из электролитов (70мл
CaCl2
+ 30мл NaCl=100мл)
а2 – антагонизм-один электролит ослабляет коагулирующее действие другого(70мл KCl + 55мл NaCl=125мл)
а3 – синергизм-один электролит усиливает коагулирующее действие другого (70мл CaCl2 + 15мл LiCl=85мл)
Золотое число
- масса (в мг) сухого ВМС, защищающего 10 мл золя красного золота от коагуляции при добавлении к нему 1 мл 10 % раствора NaCl. На рисунке защитное действие желатина эффективнее, чем крахмала (его требуется меньше!)
|
Еще раз о скорости химических реакций
Закон действия масс (ЗДМ)
Скорость гомогенной реакции при постоянной температуре пропорциональна произведению молярных концентраций реагирующих веществ, возведенных в степени, численно равные их стехиометрическим коэффициентам.
![]()
k - константа скорости
химической реакции
Например, для реакции
2СО+О2→2СО2
увеличение давления в 3 раза приводит к увеличению концентраций
каждого из исходных веществ также в 3 раза, следовательно:
V1 =k1 [СО]2 [ О2 ] = k1 [1 ]2 [1] = k1
V2 =k1 [СО]2 [ О2 ] = k1 [3 ]2 [3] = 27 k1
Скорость реакции увеличилась в 27 раз.

