
- •Введение
- •Химические элементы и простые вещества
- •Сложные вещества
- •2.1 Степень окисления элемента
- •Упражнения для самопроверки
- •2.2 Бинарные соединения
- •2.2.1 Бинарные соединения водорода
- •2.2.2 Оксиды
- •Упражнения для самопроверки
- •2.2.3 Пероксиды
- •2.3 Гидроксиды
- •Упражнения для самопроверки
- •Средние соли
- •Кислые соли
- •Основные соли
- •Номенклатура солей
- •Упражнения для самопроверки
- •2.5 Галогенангидриды
- •Упражнения для самопроверки
- •Приложение
- •Содержание
- •1 Химические элементы и простые вещества 3
- •2 Сложные вещества 5
- •Классы неорганических соединений
- •196013, Санкт-Петербург, Московский пр., 26
Упражнения для самопроверки
Напишите эмпирические и графические формулы всех оксидов Ca, Si, Fe, Sb, S, Cr и Sn. Назовите оксиды и укажите, какие оксиды относятся к основным, кислотным и амфотерным.
Какие из перечисленных оксидов N2O3, NO2, MgO, SO2, P2O5, Bi2O3, CO2, FeO способны к солеобразованию с основаниями? Напишите уравнения реакций их взаимодействия с гидроксидом кальция.
Напишите уравнения реакций солеобразования с серной кислотой и гидроксидом калия, характеризующие амфотерные свойства BeO, Al2O3, GeO, Cr2O3, GeO2.
2.2.3 Пероксиды
Соединения, содержащие кислород в степени окисления (–1), называют пероксидами. В этой степени окисления два атома кислорода образуют пероксо-группу [–O–O–], где кислород двухвалентен. Формулу пероксида можно записать исходя из формулы оксида, произведя замену кислорода О–2 на пероксо-группу О22–.
Пример
Написать эмпирическую и графическую формулу пероксида калия.
Р е ш е н и е: В фомуле оксида натрия вместо атома кислорода подставляем пероксо-группу
Na2O Na2O2; Na–O–Na Na–O–O–Na
Называют пероксиды по правилам номенклатуры бинарных соединений: Na2O2 – пероксид натрия, ВаО2 – пероксид бария.
Пероксиды щелочных и щелочно-земельных металлов представляют собой твёрдые кристаллические вещества, реагирующие с водой с образованием пероксида водорода:
BaO2 + 2H2O H2O2 + Ba(OH)2
2.3 Гидроксиды
Гидроксиды – это вещества, которые можно рассматривать как продукты соединения оксидов с водой. Многие гидроксиды так и получают, например:
CaO + H2O Ca(OH)2
P2O5 + 3H2O 2H3PO4.
Однако большинство оксидов с водой не реагируют. Их гидроксиды получают косвенным путём, например в реакциях обмена:
FeCl2 + 2NaOH Fe(OH)2 + 2NaCl
Na2SnO3 + 2HNO3 H2SnO3 + 2NaNO3.
Состав гидроксидов можно записать общей формулой – mЭхОуnН2О, где m и n – целые и дробные числа кратные ½.
Являясь производными оксидов, гидроксиды также подразделяются по характеру реакций солеобразования на три группы – основания, кислоты и амфотерные гидроксиды. Важно отметить, что характер гидроксида и соответствующего ему оксида совпадают.
Гидроксиды, вступающие в реакции солеобразования с кислотами и кислотными оксидами, называются основаниями:
Fe(OH)2 + H2SO4 FeSO4 + 2H2O
2NaOH + SO2 Na2SO3 + H2O.
Эмпирические формулы оснований получаются добавлением справа от символа металла ОН-групп в количестве, равном степени окисления металла.
Примеры
К+ОН Fe+2(OH)2 Bi+3(OH)3
При изображении графических формул оснований следует учитывать, что ОН-группы соединяются с атомом металла через кислород.
Примеры
AgOH Ag–O–H Cu(OH)2 H–O–Cu–O–H
Номенклатура оснований проста и подобна номенклатуре бинарных соединений с той разницей, что электроотрицательной частицей является не атом, а сложный ион ОН–, который в этом случае имеет название гидроксид.
Примеры
КОН – гидроксид калия CuOH – гидроксид меди(+1)
Cu(OH)2 – гидроксид меди(+2) Bi(OH)3 – гидроксид висмута(+3)
Mg(OH)2 – гидроксид магния La(OH)3 – гидроксид лантана
Гидроксиды, вступающие в реакции солеобразования с основаниями и основными оксидами, относят к кислотам. Эту группу гидроксидов правильнее называть оксокислотами:
HNO3 + NaOH NaNO3 + H2O
H2SO4 + MgO Mg(OH)2 + H2O.
Написание эмпирических формул оксокислот вызывает определённые сложности. Причина в том, что многие из них имеют несколько гидратных форм отличающихся соотношением n и m (mЭхОуnН2О), т.е. формальным содержанием воды. Различают мономерные формы – мета- и орто-, димерные и полимерные формы кислот.
Метаформа кислоты содержит минимальное число ОН-групп – одну или две. Формулу метаформы кислоты можно получить по алгоритму:
формула оксида + формула воды.
Примеры
а) Формулу метаформы кислоты кремния(+4) получаем сложив формулу оксида в формулой воды:
SiO2 + H2O = H2SiO3.
б) Метаформу кислоты фосфора(+5) получаем следующим образом:
Р2О5 + Н2О = Н2Р2О6,
В получившейся формуле численные индексы нужно сократить в два раза:
Н2Р2О6 2 = НРО3.
Ортоформа кислоты содержит ОН-групп больше, чем метаформа. Её формулу можно вывести по алгоритму:
формула метаформы кислоты + формула воды.
Примеры
а) Формулу ортоформы кислоты кремния(+4) получаем сложив формулы метаформы кислоты и воды:
H2SiO3 + H2O = H4SiO4.
б) Аналогично выводим формулу ортоформы кислоты фосфора(+5):
HPO3 + H2O = H3PO4.
В димерной форме кислоты (диформа) содержится два атома кислотообразующего элемента. Обычно димерные кислоты получаются в реакциях поликонденсации мономеров с отщеплением воды. Эту реакцию можно использовать в качестве алгоритма вывода формул дикислот. Для этого из удвоенной формулы мономера, содержащего 2 или 3 атома водорода, вычитают формулу воды.
Примеры
а) Формулу димерной кислоты кремния(+4) выводим исходя из метаформы:
2H2SiO3 – H2O = H2Si2O5.
б) Формулу димерной кислоты фосфора(+5) нужно выводить из ортоформы кислоты, так как её метаформа (HPO3) содержит только один атом водорода:
2Н3РО4 – Н2О = Н4Р2О7.
Изображение графических формул кислот следует начинать с атома кислотообразующего элемента, вокруг которого располагают атомы кислорода. Затем атомы кислорода соединяют с атомом элемента одинарными связями. Если валентность центрального атома больше числа атомов кислорода, то часть атомов кислорода соединяют с центральным атомом двойными связями. К другим атомам кислорода присоединяют одинарными связями атомы водорода.
Примеры
Ортофосфорная кислота Ортокремневая кислота
H3PO4 H4SiO4
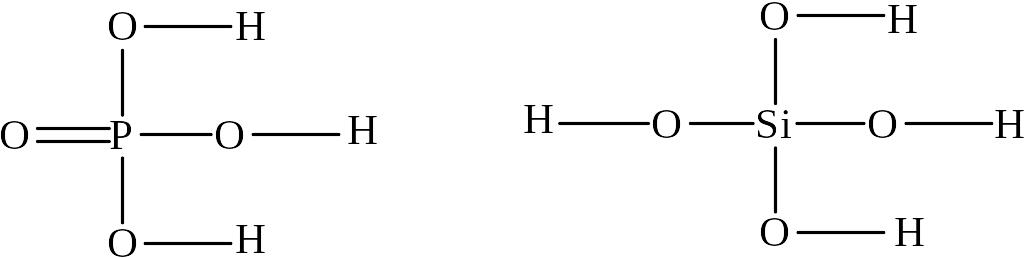
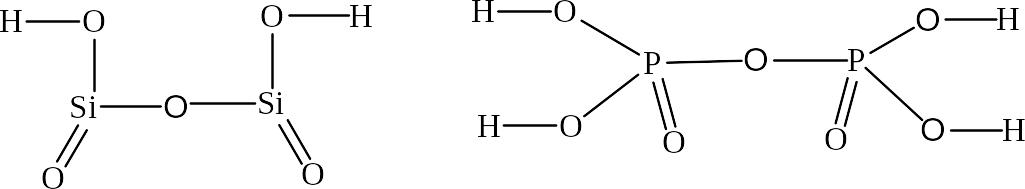
В графических формулах дикислот два атома кислотообразующего элемента соединяют кислородным мостиком, а оставшиеся атомы кислорода распределяют поровну между атомами кислотообразующего элемента. Далее поступают так же, как и в случае мономеров.
Примеры
Дикремневая кислота Дифосфорная кислота
H2Si2O5 H4P2O7
Номенклатура оксокислот. К кислотам применяется традиционная номенклатура, правила которой максимально адаптированы к русскому языку:
В названии кислоты используется русское название кислотообразующего элемента.
Названия кислот с максимальной степенью окисления кислотообразующего элемента имеют окончания «-ная», «-овая» или «-евая».
Примеры
H2C+4O3 – угольная кислота, H2Cr+6O4 – хромовая кислота, H4Si+4O4 – ортокремневая кислота.
Если кислотообразующий элемент имеет промежуточную степень окисления, то в название добавляется суффикс «-ист-».
Примеры
HN+3O2 – азотистая кислота, H2S+4O3 – сернистая кислота.
Если у кислотообразующего элемента несколько промежуточных степеней окисления, то для обозначения низшей степени окисления и степени окисления ближайшей к высшей в название кислоты добавляется суффикс «-оват-».
Пример
В случае оксокислот хлора это правило выполняется в полном объёме:
HCl+7O4 – хлорная кислота,
HCl+5O3 – хлорноватая кислота,
HCl+3O2 – хлористая кислота,
HCl+1O – хлорноватистая кислота.
Гидратные формы кислот указываются приставками «мета», «орто», «ди» и др.
Примеры
HPO3 – метафосфорная кислота,
H3PO4 – ортофосфорная кислота,
Н4Р2О7 – дифосфорная кислота,
Н5Р3О10 – трифосфорная кислота.
Следует отметить, что у ряда элементов – С, N, Cl, Br, I – не
существуют димерные формы кислот. У элементов C, N, S, Se, Cl, Br не существует ортоформ кислот, поэтому в названиях метаформ кислот приставка «мета» обычно опускается.
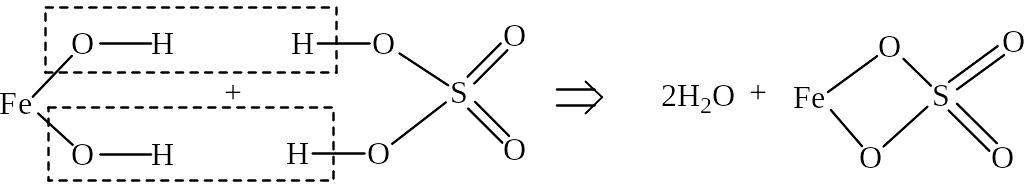
Кислотно-основные свойства гидроксидов определяются свойствами ОН-группы. У оснований легко отщепляется ОН-группа с образованием иона металла и гидроксид-иона – ОН–. В кислотах, напротив, от ОН-группы легко отщепляется водород с образованием иона кислотного остатка и иона водорода – Н+. Эти свойства гидроксидов определяют протекание реакций нейтрализации:
Основание + Кислота = Вода + Соль
Fe(OH)2 + H2SO4 = 2H2O + FeSO4
По числу замещаемых ОН-групп основания делятся на однокислотные, двухкислотные, трёхкислотными и т.д.. По числу замещаемых ионов водорода кислоты подразделяются на одноóсновные, двухóсновные, трёхóсновные и т.д..
В ряде гидроксидов в равной степени могут отщепляться и ионы Н+ и ионы ОН–, т.е. гидроксиды могут проявлять свойства кислот и оснований.
Гидроксиды проявляющие свойства кислот и оснований называются амфотерными гидроксидами.
Типичным амфотерным гидроксидом является гидроксид цинка:
Zn(OH)2 + 2HNO3 2H2O + Zn(NO3)2
H2ZnO2 + 2NaOH 2H2O + Na2ZnO2.
Из приведённого примера видно, что эмпирические формулы амфотерных гидроксидов можно записывать как формулы оснований, так и кислот. Такой подход допускается и в названиях амфотерных гидроксидов.
Примеры
Zn(OH)2 – гидроксид цинка или H2ZnO2 – цинковая кислота
Sb(OH)3 – гидроксид сурьмы(+3) или H3SbO3 – ортосурьмянистая кислота
