- •2. Потенциометрия
- •2.1. Основные понятия и законы, особенности методики, используемое оборудование
- •2.1.1. Что такое гальванический электрод?
- •2.1.2. Термодинамика гальванического элемента. Уравнение Нернста
- •2.1.3. Основные типы электродов. Наиболее распространённые электроды
- •2.1.4. Объединение электродов в измерительную ячейку
- •2.1.5. Измерение эдс элемента
- •2.1.6. Измерение рН
- •2.1.7. Ионометрия
- •2.1.8. Теория Дебая – Хюккеля
- •2.2. Лабораторные работы.
- •2.2.1. Работа п-1. Потенциометрическое определение коэффициентов активности соляной кислоты
- •2.2.2. Работа п-2. Определение константы диссоциации слабой кислоты потенциометрическим методом
- •2.2.3. Работа п-3. Измерение температурного коэффициента эдс гальванического элемента и расчёт термодинамических величин
- •2.3. Контрольные вопросы
2.1.3. Основные типы электродов. Наиболее распространённые электроды
Электрод первого рода представляет собой металл, опущенный в раствор, содержащий ионы этого же металла. Если такой электрод в гальваническом элементе является анодом, то металл при протекании реакции окисляется и растворяется, если катодом – то восстанавливается из раствора. Примерами электродов первого рода являются электроды, из которых составлен элемент Даниэльса – Якоби.
Серебряный электрод Ag+|Ag, в котором протекает реакция
![]()
также является электродом первого рода. Потенциал этого электрода равен
![]() (2.6)
(2.6)
Электрод второго рода состоит из металла, покрытого слоем труднорастворимого соединения этого металла и опущенного в раствор соли, содержащей тот же анион, что и в используемом труднорастворимом соединении металла. Потенциал электрода второго рода зависит от концентрации аниона, не участвующего в окислительно-восстановительной реакции.
На первый взгляд это определение кажется странным, однако, заметьте, что в нём не утверждается, что потенциал электрода второго рода не зависит от концентрации катионов металла, принимающего участие в окислительно-восстановительной реакции.
Примерами электродов второго рода являются хлорсеребряный и каломельный электроды.
Хлорсеребряный электрод Cl–,AgCl|Ag – это то, во что превращается серебряный электрод Ag+|Ag, если поверхность серебра покрыть слоем AgCl, а в раствор добавить электролит, содержащий хлорид-ионы1. Поскольку ионы Cl– не участвуют в электродной реакции, то потенциал электрода в соответствии с уравнением Нернста не должен зависеть от их концентрации, а будет определяться концентрацией ионов серебра. Это верно, но с оговоркой: сама эта концентрация в данном случае задаётся концентрацией хлорид-ионов, поэтому изменение концентрации последних всё-таки влияет на электродный потенциал. Действительно, учитывая произведение растворимости
L(AgCl) = [a(Ag+)][a(Cl–)],
можно переписать выражение (2.6), как
 (2.7)
(2.7)
Здесь .0 – стандартный электродный потенциал серебряного электрода первого рода, а 20 – стандартный электродный потен-циал хлорсеребряного электрода второго рода. Видно, что величина концентрации хлорид-ионов однозначно определяет потенциал хлорсеребряного электрода. Полуреакция для хлорсеребряного электрода может быть записана как
![]()
Хлорсеребряный электрод обладает постоянным и хорошо воспроизводимым потенциалом. В электрохимических ячейках он широко используется в качестве электрода сравнения.
Каломельный электрод Cl–,Hg2Cl2|Hg представляет собой каплю ртути, поверхность которой полностью покрыта каломелью (закисной хлористой ртутью), электролитом является насыщенный раствор KCl или раствор KCl с концентрацией от 1,0 до 3,8 М. Электродная реакция для такого электрода записывается следующим образом:
1/2![]()
Электроды на
основе инертных благородных металлов
(Pt,
Au,
Pd,
Ir).
Потенциал этих электродов определяется
только окислительно-восстановительными
свойствами реагентов, и не зависит от
материала металлической части электрода.
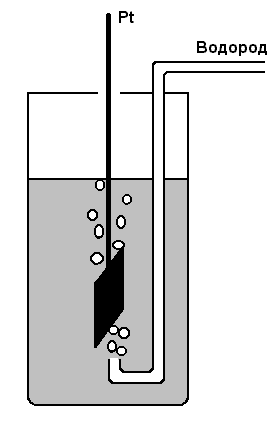
Примером является водородный электрод
Pt,
H2|H+,
изображённый на рис. 2.2, в котором
протекает реакция
![]() Он представляет собой пластинку из
платинированной платины, погружённую
в электролит, через который пропускают
водород со скоростью 2–3 пузырька в
секунду. Потенциал водородного электрода
равен
Он представляет собой пластинку из
платинированной платины, погружённую
в электролит, через который пропускают
водород со скоростью 2–3 пузырька в
секунду. Потенциал водородного электрода
равен
![]() (2.8)
(2.8)
Рис. 2.2. Водородный электрод |
Если давление водорода равно 1 атм и активность ионов водорода в растворе равна 1 моль/л, то водородный электрод называется нормальным водородным электродом (НВЭ). Стандартный электродный потенциал НВЭ равен нулю при любой температуре. Водородный электрод можно использовать в широком диапазоне температур и рН. Он может работать в щелочных растворах до концентрации 4 М, в растворах серной кислоты – до 17 М. К недостаткам водородного электрода следует отнести высокие требования к чистоте водорода и электролита. |