
- •1.Законы поглощения электромагнитного излучения
- •2. Способы и оптимизация условий определения веществ фотометрическим методом
- •3. Дифференциальные фотометрические методы
- •4. Анализ двухкомпонентных смесей
- •Общие указания
- •Лабораторная работа №1
- •(Визуальный метод)
- •Реагенты
- •Значения рН буферных растворов и объем раствора
- •2.1. Определение кальция с кислотным хром синим к
- •Реактивы
- •2.2. Определение никеля диметилгликсимом в присутствииокислителей
- •Реагенты
- •2.3. Определение железа (III) сульфосалициловой кислотой
- •Реагенты
- •Выполнение работы.
- •2.4. Определение фосфора в виде фосфорномолибденовой сини
- •Реагенты
- •Выполнение работы.
- •2.5. Определение хрома дифенилкарбазидом
- •Реагенты Фотоколориметры
- •Выполнение работы.
- •Лабораторная работа № 3. Определение больших количеств веществ методом дифференциальной абсорбционной спектроскопии
- •3.1. Определение меди в м едных сплавах.
- •Реагенты
- •3.2. Определение меди в медных сплавах в виде аммиачногго комплекса.
- •Реагенты
- •3.3. Определение меди в медных сплавах в виде аквакомплексов
- •Реагенты
- •3.4. Определение никеля в растворе его соли в виде аквакомплексов.
- •Реагенты
- •3.5. Определение больших количеств марганца в виде перманганат-иона
- •Реагенты
- •4.1. Спектрофотометрический анализ двухкомпонентной смеси: метиловый фиолетовый – бриллиантовый зеленый
- •Реагенты
- •4.2. Спертофометрическое определение равновесных концентраций сопряженных кислотно-основных форм метилого оранжевого в растворе.
- •Реагенты
Методические указания к выполнению лабораторных работ по дисциплине « Физико- химические методы анализа»
(кафедральный вариант)
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ.
АБСОРБЦИОННАЯ МОЛЕКУЛЯРНАЯ
СПЕКТРОСКОПИЯ В УФ И ВИДИМОЙ ОБЛАСТИ
Аналитическая абсорбционная молекулярная спектроскопия в УФ и видимой области исследует сигналы в диапазоне длин волн 100 — 750 нм, связанные с возбуждением электронной системы молекулы. В зависимости от типов абсорбционных спектральных приборов, используемых для регистрации указанных сигналов, различают фотометрический и спектрофотометрический методы. Их сравнительная характеристика приведена в табл. 1. Оба метода объединяют в одну группу фотометрических методов анализа.
Таблица 1. Фотометрические методы анализа
Метод |
Тип прибора |
Рабочая область спектра, нм |
Способ моно-хроматизации |
Регистрируемые сигналы |
|
Фотометр (фотоколориметр) |
Видимая 400 — 750 |
Светофильтр |
Оптическая плотность (А) и пропускание (Т) в диапазоне длин волн, отвечающем полосе пропускания светофильтра |
|
Спектрофотометр |
УФ и видимая 100 — 750 |
Монохроматор или полихроматор |
Оптическая
плотность (А)
и
пропускание (Т)
при
фиксированной
длине воины;
электронные спектры
поглощения в форме кривых
А =f( |
1.Законы поглощения электромагнитного излучения
Ослабление мощности монохроматического потока излучения при прохождении через слой раствора поглощающего вещества описывается основным законом светопоглощения:
lg Ф0 / Ф = А = - lg T = klc, (1)
где Ф0 и Ф — мощности потоков монохроматического излучения, падающего на слой раствора и вышедшего из него, соответственно; А — оптическая плотность; Т— пропускание; k — коэффициент поглощения вещества; l — толщина слоя; с — концентрация поглощающего вещества в растворе.
Коэффициент k зависит от природы вещества, растворителя, длины волны (частоты) излучения и имеет размерность, обратную произведению размерностей l и с. Значение k при выбранной длине волны можно рассчитать по формуле (1), зная концентрацию вещества, толщину поглощающего слоя и значение оптической плотности или пропускания при выбранной длине волны. Абсолютная величина коэффициента поглощения характеризует чувствительность определения вещества S при l = 1 см:
S = (dA / dc)l = 1см = k (2)
Однако расчет по формуле (1) не всегда дает представление об истинном значении коэффициента поглощения. Это связано с тем, что для его получения необходимо соблюдение ряда условий:
- поглощаемое излучение строго монохроматично; - пучок монохроматических лучей, проходящих через раствор, плоскопараллелен;
- раствор поглощающего вещества представляет собой гомогенную нерассеивающую изотропную среду;
- при данной длине волны (частоте) поглощает только один тип частиц вещества, а растворитель прозрачен;
- заселенность возбужденных энергетических уровней частиц при поглощении монохроматического светового потока незначительна;
- поглощающие частицы равномерно заполняют световой поток;
- в растворе не протекают побочные химические реакции, изменяющие концентрацию поглощающих частиц;
- поглощающие частицы не взаимодействуют между собой;
на поглощающие частицы не оказывают влияния ни растворитель, ни ионная сила раствора;
- концентрация поглощающих частиц в растворе точно известна.
На
практике такие условия выполняются не
всегда. Поэтому чаще
всего по формуле (1) вычисляют некоторую
усредненную величину
![]() .
.
Если
концентрация вещества в растворе
выражена в моль•л-1,
а
толщина поглощающего слоя в см,
то коэффициент поглощения
обозначают символом
![]() и называют молярным коэффициентом
поглощения. Его размерность — л
•
моль-1
• см
-1,
а численное
значение равно оптической плотности
раствора с концентрацией
1 моль•л-1
при толщине поглощающего слоя 1см.
Для полос,
соответствующих разрешенным электронным
переходам,
принимает значение 103
- 105.
и называют молярным коэффициентом
поглощения. Его размерность — л
•
моль-1
• см
-1,
а численное
значение равно оптической плотности
раствора с концентрацией
1 моль•л-1
при толщине поглощающего слоя 1см.
Для полос,
соответствующих разрешенным электронным
переходам,
принимает значение 103
- 105.
Концентрацию
растворов веществ с неизвестными
молярными массами обычно выражают
в массовых долях. Если массовую долю
измеряют в процентах, а толщину
поглощающего слоя в
см,
то в этом случае коэффициент поглощения
обозначают символом
Е![]() и называют удельным коэффициентом
поглощения. Последний численно равен
оптической плотности 1%-ного раствора
при l=
1см.
и называют удельным коэффициентом
поглощения. Последний численно равен
оптической плотности 1%-ного раствора
при l=
1см.
Рис.
1. Зависимость А
от
с
при
1=сonst
в случае соблюдения основного
закона светопоглощения (1),положительных
(2),
отрицательных
(3)
отклонениях
от него.
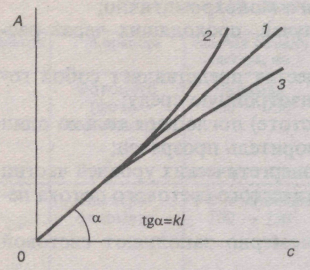
Причины, вызывающие отклонения от основного закона светопоглощения, можно разделить на инструментальные и химические.
Инструментальные
связаны с
тем, что при измерениях практически
всегда имеют дело с
потоками излучения, охватывающими
некоторый конечный интервал длин волн
![]() (частот
(частот
![]() ),
а не с идеально монохроматической
волной
(частотой
).
Работа
с немонохроматическими
пучками приводит к отрицательным
отклонениям от основного закона
светопоглощения.
Наиболее часто инструментальные причины
проявляются при
работе на фотометрах.
),
а не с идеально монохроматической
волной
(частотой
).
Работа
с немонохроматическими
пучками приводит к отрицательным
отклонениям от основного закона
светопоглощения.
Наиболее часто инструментальные причины
проявляются при
работе на фотометрах.
Химические причины обусловлены изменением числа поглощающих частиц вещества вследствие протекающих в растворе реакций протолиза, комплексообразования, окисления — восстановления и осадкообразования. Вызванные ими отклонения от основного закона светопоглощения могут быть как положительными, так и отрицательными и служат основой для изучения состояния веществ и равновесий в растворах.
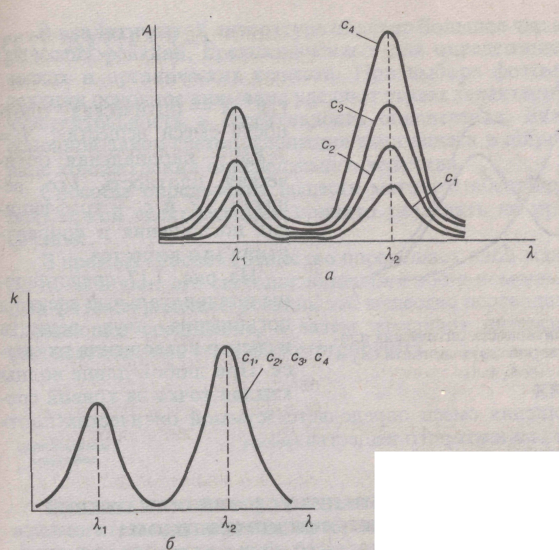
При соблюдении основного закона светопоглощения в широком интервале длин волн спектры поглощения вещества в координатах А - (А - ) имеют одинаковую форму независимо от толщины поглощающего слоя или концентрации вещества в растворе и характеризуются сохранением положения максимумов полос поглощения при одних и тех же длинах волн (частотах). Серии кривых А =f( ) или
А =f( ), соответствующих различным значениям с и l, будет отвечать одна кривая k=f( ) или k=f( ) (рис. 2). В случае неподчинения основному закону светопоглощения кривые k=f( ) или k=f( ) для растворов одного и того же вещества различной концентрации обычно не совпадают (рис. 3).
Рис.
2. Спектры поглощения растворов различной
концентрации, подчиняющихся основному
закону светопоглощения, в координатах
А-
(а)
и
k-
(б); c1<с1<с3<с4.
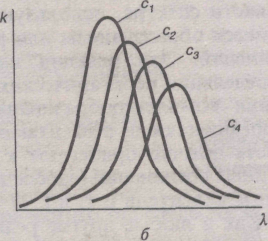
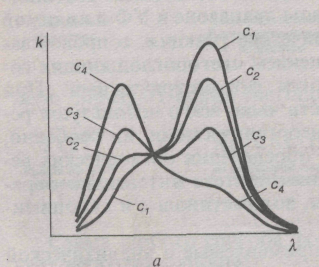
а — изменение интенсивности полос поглощения от концентрации; б — изменение интенсивности и положения полос поглощения от концентрации.
А
=
![]() = l
= l![]() i
ci,
(1-2)
i
ci,
(1-2)
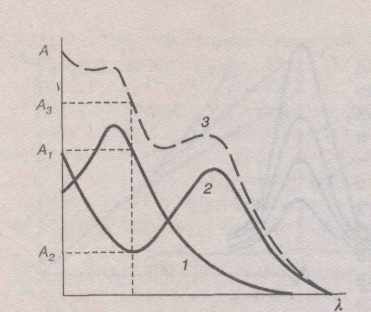
где А — оптическая плотность смеси вещества; Ai= kilci — парциальная оптическая плотность i-го вещества; ki и сi — коэффициент поглощения и концентрация i-го вещества.
На рис. 4 представлены индивидуальные спектры поглощения двух веществ и спектр поглощения их смеси. При любой длине волны каждая точка на кривой спектра поглощения смеси определяется суммой оптических плотностей первого и второго вещества.
