
- •Тема 1. Теорія будови органічних сполук
- •Номенклатура в органічних сполуках.
- •Види зв’язку в органічних сполуках. Фактори, що впливають на реакційну здатність речовин.
- •Механізм реакції
- •Тема 2. Насичені вуглеводні
- •Циклоалкани
- •Тема 3. Ненасичені вуглеводні
- •Алкіни (ацетиленові вуглеводні)
- •Дієнові вуглеводні
- •Тема 3. Ароматичні вуглеводні
- •Механізм реакцій електрофільного заміщення:
- •Природні джерела вуглеводнів
- •Тема 4. Спирти і феноли Спирти
- •Насичені одноатомні
- •Багатоатомні спирти
- •Тема 5. Альдегіди, кетони та карбонові кислоти.
- •Альдегіди
- •Карбонові кислоти
- •Мурашина Кислота
- •Бензойна кислота
- •Тема 6. Складні ефіри.
- •С кладні ефіри (естери)
- •Тема 7. Вуглеводи
- •Глюкоза
- •Фруктоза
- •Рибоза та дезоксирибоза
- •Мальтоза та цукроза
- •Тема 8. Нітрогеновмісні органічні сполуки
- •Амінокислоти
- •1. Денатурація
- •2. Гідроліз
- •3. Якісні реакції білків
- •Тема 9. Високомолекулярні сполуки
1. Денатурація
Руйнування третинної і третинної структури білків під дією хімічних реагентів, нагрівання або радіації
2. Гідроліз
Руйнування первинної структури білків під дією хімічних реагентів (луги, кислоти, ферменти) з утворенням a-амінокислот
3. Якісні реакції білків
• біуретова реакція
При взаємодії білків з солями міді у лужному середовищі спостерігається поява фіолетового забарвлення. Дана реакція характеризує наявність пептидних зв'язків:
-CO - NH-
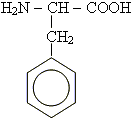 • ксантопротеїнова
реакція
• ксантопротеїнова
реакція
При дії нітратної кислоти на білки спостерігається поява жовтого
забарвлення. Дана реакція характеризує наявність бензольних ядер,
що входять до складу деяких амінокислот, наприклад, фенілаланіну:
Кольорові реакції:
1)Ксантопротеїнова
При взаємодії з азотною кислотою білки з ароматични амінокислотами дають жовтий колір, тобто відбувається нітрування ароматичного кільця.
Білок з ароматичною а/к + HONO2 → жовтий колір
2)Біуретова
З солями міді та лугами білки дають фіолетовий колір.

3)Реакція Мілона
З розчином нітрату труті в азотистій кислоті білки дають червоний колір. Ця реакція пов’язана з наявністю фенольної групи:
С6Н5ОН + Hg(NO3)2 → червоне забарвлення
4)Сульфгідридна
При нагріванні білків з розчином плюмбіта Na випадає чорний осад сульфіда свинця. Ця реакція вказує на наявність сульфідний груп.
S H + CH3(COO)2Pb → PbS чорний осадок
5) Нінгідринова ( на пентидний зв'язок)

Тема 9. Високомолекулярні сполуки
Високомолекулярні сполуки (полімери) – речовини, молекули яких складаються з великої кількості елементарних (мономерів) ланок, що повторюються, і сполучаються між собою хімічним зв’язком.
Будова:
молекули полімерів можуть мати будову: лінійну, розгалужену, просторову.
Лінійна будова:
довгі ланцюги, що складаються з послідовно сполучених елементарних ланок.
Приклад: [–CH2–CH2–]n
Розгалужена будова: характерне утворення поперечних хімічних зв’язків між макромолекулами
Приклад:

Просторова будова: характерне утворення поперечних хімічних зв’язків між макромолекулами
Приклад:

Синтез – вихідними речовинами для синтезу полімерів є мономери. Основна вимога: мономери мають бути не менш ніж біфункціональними, тобто, щоб кожна взаємодіяла щонайменше з 2ма такими самими або іншими молекулами.
Полімеризація – процес сполучення між собою мономерів з утворенням полімерів, який не супроводжується виділенням побічних продуктів реакції. Для цього використовують низькомолекулярні сполуки з подвійними зв’язками.
Процес полімеризації має 3 етапи:
Утворення вільного радикала або йона
ріст ланцюга
обривання ланцюга.
Розрізняють радикальну і іонну полімеризацію.
Радикальну спричиняють речовини, які під дією світла, опромінення розпадаються з утворенням вільних радикалів:
![]()
Іонна відбувається за наявності каталізаторів, які перетворюють молекули мономера на хімічно активні катіони або аніони.
2) Поліконденсація – утворення полімеру внаслідок взаємодії функціональних груп мономерів, під час якої виділяються вода, аміак, хлороводень, тощо. У кожної молекули мономера має бути щонайменше дві функціональні групи.
Приклад:

Властивості: Переважна більшість полімерів не розчиняється у воді і погано розчиняється в органічних розчинниках. Під час нагрівання розкладаються. За відношенням до нагрівання поділяються на термопластичні та термореактивні.
Термопластичні – ті, що під час нагрівання розм’якшуються, плавляться, змінюють свою форму.
Термореактивні – під час нагрівання спочатку стають пластичними, але згодом втрачають пластичність і розчинність.
Залежно від будови та розміщення макромолекул у полімерах останні можуть перебувати в аморфному або кристалічному стані.
Кристалічні: характерне паралельне розміщення.
Аморфні: впорядкованість відсутня. Залежно від умов можуть перебувати у склоподібному, високо еластичному і в’язкотекучому стані.
Поліетилен
Синтез із метана:
![]()
В промисловості добувають полімеризацією етилену за високого, середнього та низького тиску, за наявності кисню, ініціаторів радикальної полімеризації. Тверда, рогоподібна речовина молочно-білого кольору
Поліпропілен
Синтез із метану
nCH2=CH(CH3) → [-CH2-CH(CH3)-]n
Залежно від природи каталізаторів можна добути стереорегулярний поліпропілен і стерео нерегулярний.
С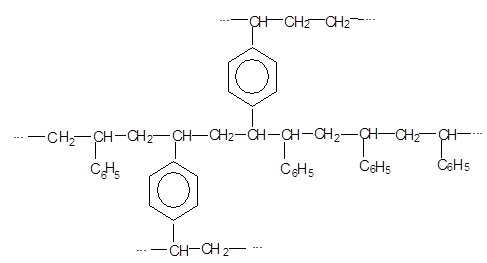 тереорегулярний
– радикали розміщені впорядковано
відносно основного ланцюга
тереорегулярний
– радикали розміщені впорядковано
відносно основного ланцюга
Стереонерегулярний – радикали розміщені хаотично.
Полістирол

Каталізатор: пероксид бензену.
Тверда, прозора, склоподібна речовина. Внаслідок нагрівання до 300-400 градусів де полімеризується з утворенням мономеру. Лінійна будова.
Поліметилметакрилат
nCH2=C(CH3)-COOCH3 [-CH2-C(CH3)(COOCH3)-]n
У промисловості найчастіше добувають способами білкової та емульсійної полімеризації.
Прозорий, з аморфною структурою полімер.
Полівінілхлорид
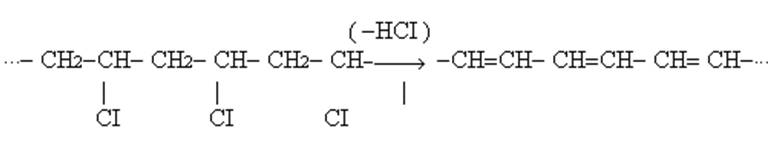
Ступінь полімеризації =100-2500
Білий аморфний порошок.
Політетрафторетилен (фторопласт-4)

Сухий волокнистий порошок.
Натуральний каучук.
У промисловості натуральний каучук отримують з латексу - молочного соку рослин-каучуконосів. Найбільш важливим каучуконосом є гевея - тропічна рослина сімейства молочайних. Спочатку латекс отримують з надрізів на стволах гевеї. Потім при дії на латекс мурашиної або оцтової кислоти відбувається каогуляція каучуку. Отриманий каучук промивають водою і прокатують на вальцях.
Ф еноформальдегідні
смоли
еноформальдегідні
смоли
Термопластичні (новолаки) (присутність кислого каталізатора, нестача)
Термореактивні (резоли) (лужний каталізатор, надлишок)
Отвердіння термореактивних смол (перехід до незворотного стану) – 3 стадії:
Тверда, плавка, рідка смола
резитол (тягуча маса)
Резит
Волокна
Природні – бавовна, шовк, вовна, льон
Штучні – добуваються хімічним обробленням природних полімерів: Віскозне, ацетатне
Синтетичні – добувають хімічним способом
Ацетатне волокно
![]()
Виготовляють на основі ацетатних естерів бовавникової або деревної целюлози.
Віскозне волокно
Ксантогенат утворюється
з лужної Ц. в результаті р-ції:
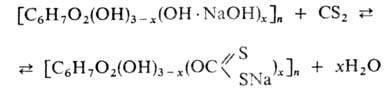
![]() При взаємодій. NaOH
Na2CS3 с
і О2 повітря утворюється складна суміш сірчистихсоед. Na
(сульфід, полісульфід,
сульфіт, тіосульфат та
ін.)
При взаємодій. NaOH
Na2CS3 с
і О2 повітря утворюється складна суміш сірчистихсоед. Na
(сульфід, полісульфід,
сульфіт, тіосульфат та
ін.)
Вискозу пропускають крізь розчин сірчаної кислоту або питної соди.
Синтетичні волокна:
HOOC-C6H4-COOH + HO-CH2CH2-OH + HOOC-C6H4-COOH + … →
→ HOOC-C6H4-CO – O-CH2CH2-O – OC-C6H4-CO – … + nH2O
