
- •4. Охорона навколишнього середовища і хімічна технологія
- •4. 1. Класифікація промислових забруднень біосфери
- •4.2. Основи промислової екології
- •4.3. Основні положення екології
- •4.4. Екологічні проблеми хімічної технології
- •4.5. Очищення промислових газових викидів
- •4.6. Утилізація твердих відходів
- •4.7. Очищення стічних вод хімічних виробництв
- •5. Виробництво сульфатної кислоти
- •5. 1. Основні властивості та застосування сульфатної кислоти
- •5.2. Методи виробництва сульфатної кислоти
- •5.3. Сировинна база сульфатнокислотного виробництва
- •5.4. Хімічна схема виробництва сульфатної кислоти з колчедану
- •5.5. Фізико–хімічне обґрунтування технологічних режимів стадій виробництва сульфатної кислоти
- •5.6. Технологічна схема виробництва сульфатної кислоти методом пкпа
- •5.7. Удосконалення сульфатнокислотного виробництва
- •6. Технологія аміаку і нітратної кислоти
- •6.2. Синтез аміаку
- •6.3. Способи виробництва аміаку з азоту повітря кон-тактним методом
- •6.4. Хімічна і принципова схеми виробництва аміаку
- •6.5. Фізико-хімічне обґрунтування режимів виробництва синтез− газу
- •6.6. Очищення природного і конвертованого газів
- •6.7.Фізико-хімічні основи синтезу аміаку
- •6.8. Технологічна схема синтезу аміаку під середнім тиском
- •6.9. Виробництво нітратної кислоти
- •6.9.1. Сорти і області застосування нітратної кислоти
- •6.9.2. Хімічна і функціональна схеми виробництва розведеної нітратної кислоти
- •6.10. Технологічна схема виробництва розведеної нітратної кислоти
- •6. 11. Виробництво концентрованої нітратної кислоти
- •6.11.1. Концентрування нітратної кислоти
- •6.11.2. Прямий синтез концентрованої нітратної кислоти
- •6.12. Охорона навколишнього середовища у виробництві нітратної кислоти
6. 11. Виробництво концентрованої нітратної кислоти
Для деяких виробництв потрібна концентрована кислота з вмістом більше 96% HNО3. Для виробництва нітратної кислоти, що містить 96–98% HNО3, застосовують два методи: концентрування розведеної нітратної кислоти з використанням водовіднімаючих речовин; прямий синтез нітратної кислоти з оксидів азоту (IV) за тиску близько 5МПа.
6.11.1. Концентрування нітратної кислоти
Для виробництва концентрованої нітратної кислоти з умістом більше 96% HNО3 звичайно застосовують перегонку розведеної нітратної кислоти у присутності концентрованої сульфатної кислоти як водовіднімаючого засобу.
Перегонку розведеної нітратної кислоти з концентрованою сульфатною кислотою (92 – 94%) здійснюють у тарілчастих барботажних колонах або у колонах з насадкою з кілець.
На рис. 6.14 наведена принципова схема установки для концентрування розведеної нітратної кислоти.
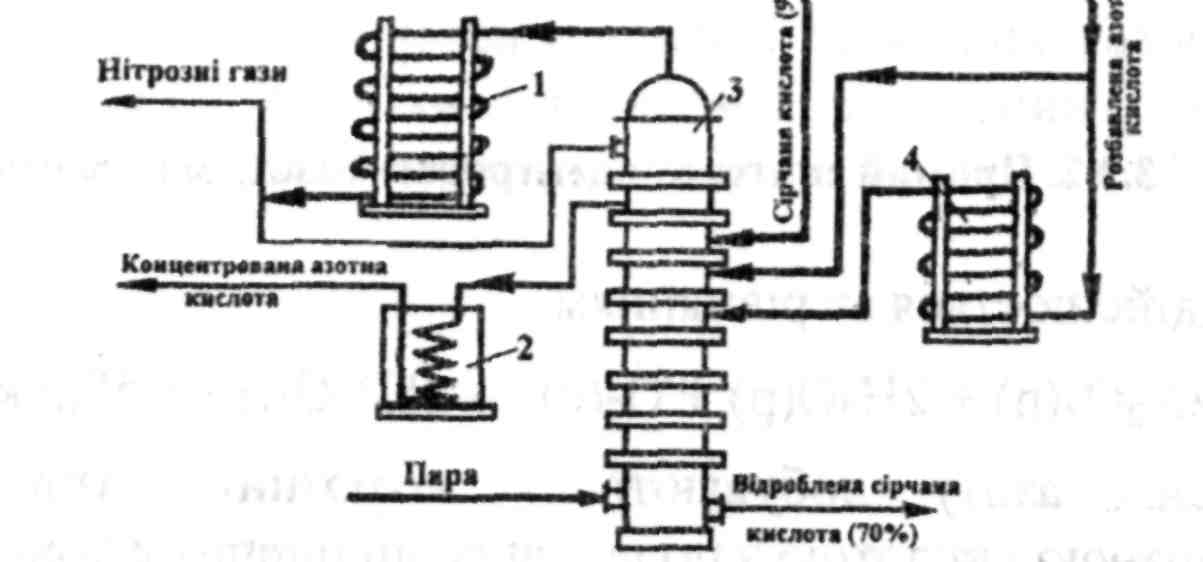
Рис. 6.14. Принципова схема установки для концентрування розведеної нітратної кислоти: 1 – конденсатор; 2 – холодильник; 3 – барботажна концентраційна колона; 4 – випарник розведеної нітратної кислоти
Установка для концентрування розведеної нітратної кислоти працює у такий спосіб. Сульфатна кислота надходить на одну з верхніх тарілок барботажної концентраційної колони 3. Дещо нижче до колони подається розведена 50% нітратна кислота, частина якої пропускається крізь випарник 4. Нагрівання суміші здійснюється гострою парою (180-200°С), яка вводиться у нижню частину колони. Пари нітратної кислоти з незначним умістом парів води та оксидів азоту, які утворилися внаслідок розкладання нітратної кислоти, направляються з колони 3 у конденсатор 1, де нітратна кислота конденсується, а нітрозні гази (оксиди азоту) надходять на подальше уловлювання. Частина оксидів азоту розчиняється у нітратній кислоті, тому з конденсатора 1 вона повертається на верхні тарілки колони, де продувається, а потім відводиться як продукція у холодильник 2. Відпрацьована сульфатна кислота (70%) надходить без охолодження безпосередньо на випарювання.
Для повернення відпрацьованої сульфатної кислоти у процес її слід концентрувати до купоросного масла. Це пов'язано з великою витратою палива, безповоротними витратами певної кількості сульфатної кислоти і з сильною корозією апаратури. Тому тепер у промисловості застосовується метод концентрування розведеної нітратної кислоти перегонкою у присутності Mg(NО3)2 як водовідбираючої солі.
6.11.2. Прямий синтез концентрованої нітратної кислоти
Прямий синтез HNО3 заснований на взаємодії рідких оксидів азоту з водою і газоподібним киснем під тиском до 5 МПа за рівнянням сумарної реакції:
2N2О4(p) + 2Н2О(р) + О2(г) <-> 4HNО3(p) + 78,8 кДж.
Оксид азоту (IV) добувають з нітрозних газів абсорбцією концентрованою кислотою з подальшим виділенням концентрованого NО2.
Вилучення оксиду азоту (IV) з нітрозних газів засноване на хорошій розчинності оксиду азоту (IV) у концентрованій нітратній кислоті (97-98%) за низьких температур (–10°С) з одержанням нітроолеуму за рівнянням реакції:
nNО2 + HNО3 = HNO3∙n NO2.
З нітроолеуму у вибілюючих колонах за нагріванні до 800 С виділяється газоподібний оксид азоту (IV), який направляється на конденсацію охолодженням (–80 С).
Рідкий NО2 (N2О4) змішують з розведеною нітратною кислотою, що містить 40–45% води, і направляють в автоклав, куди подається також кисень. В автоклаві за 90°С та 5 МПа відбувається реакція утворення нітратної кислоти. Для зміщення рівноваги у бік утворення нітратної кислоти, а також збільшення швидкості реакції необхідно, щоб у суміші, яка надходить в автоклав, був надлишок рідкого N2О4. Ступінь поглинання оксидів азоту становить приблизно 100%.
З автоклава концентрована кислота, що містить приблизно 25% NО2, подається разом з нітроолеумом у вибілюючу колону. Звільнена від оксидів азоту кислота частково виділяється як продукційна 97 – 98%-а кислота, а частково знов використовується для одержання нітроолеуму.
