- •Кількісний аналіз
- •Інструкція до навчальної практики №1
- •Контроль знань
- •Лабораторна робота
- •Хід виконання роботи:
- •Інструкція до навчальної практики №2
- •Контроль знань
- •Лабораторна робота
- •Хід виконання роботи:
- •Маса 1 дм3води (г) при різних температурах (°с)
- •Інструкція до навчальної практики №3
- •Контроль знань
- •Лабораторна робота
- •Хід виконання роботи:
- •Титриметричний аналіз.
- •Алгоритм характеристики методу об’ємного аналізу
- •1.Приготування вихідного розчину – Na2в4o7 • 10h2o
- •2.Стандартизація робочого розчину hCl (за вихідним розчином Na2в4o7 • 10h2o)
- •Інструкція до навчальної практики №5
- •Лабораторна робота
- •2.Аналіз досліджуваної речовини:
- •Контрольні завдання
- •Інструкція до навчальної практики №6
- •Лабораторна робота
- •1.Приготування вихідного розчину – NаСl
- •2.Аналіз досліджуваної речовини: (Спосіб титрування прямий)
- •Контрольні завдання
- •Інструкція до навчальної практики №8
- •Лабораторна робота
- •Стандартизація робочого розчину nh4scn(за титрованим робочим розчином AgNo3)
- •2.Аналіз досліджуваної речовини:( Спосіб титрування зворотній)
- •Контрольні завдання
- •Інструкція до навчальної практики №9
- •Приготування вихідного розчину – MgSo4 ·7h2o
- •Приготування робочого розчину – Трилону б
- •Стандартизація робочого розчину –Трилону б (за вихідним розчином MgSo4 · 7h2o)
- •Інструкція до навчальної практики №10
- •Хід роботи
- •Аналіз досліджуваної речовини:( Спосіб титрування прямий)
- •Контрольні завдання
- •2. Стандартизація робочого розчину kMnO4
- •Контрольні завдання
- •Інструкція до навчальної практики №14 -15
- •Лабораторна робота
- •1.Приготування вихідного розчину – k2Cr2o7
- •2.Стандартизація робочого розчину Na2s2o3 за вихідним розчином k2Cr2o7
- •3.Аналіз досліджуваної речовини: (Спосіб титрування прямий)
- •Контрольні завдання
- •Інструкція до навчальної практики №16
- •10.Результати оформити за схемою:
- •Інструкція до навчальної практики №17
- •Підготувати іономір до роботи згідно інструкції користувача приладом
- •Потенціометрія
- •Хід виконання
- •Інструкція до навчальної практики №18
- •Інструкція до навчальної практики №19
1.Приготування вихідного розчину – Na2в4o7 • 10h2o
За точно взятою наважкою
|
З фіксаналу |
|
|
|
|
qтеор
|
q =0,1·190,72·1=19,072г
|
1
З Зважити(q) у бюксі на аналітичних терезах (2)(mаналіт) =____ Висипати (q) у вимірювальну колбу(3), Зважити порожній бюкс на аналітичних терезах(mб.)=______ q(практ) = m(аналіт) – m(б.); q(практ)=____________ |
|
|
Cпр. (Na2В4O7 • 10H2O)=0,1моль/дм3 |
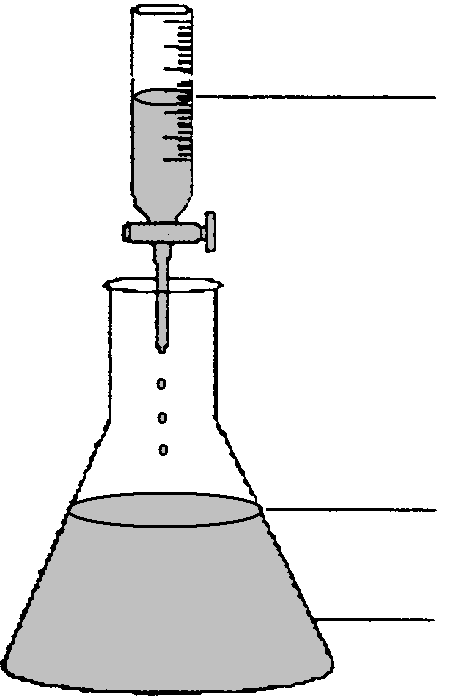
2.Стандартизація робочого розчину hCl (за вихідним розчином Na2в4o7 • 10h2o)
2HCl+Na2В4O7+5H2O →2NaCl+4H3ВО3
HCl
Na2В4O7 (10,00см3)
Метиловий оранжевий |
![]()
![]()
![]() ;
Vс. =
;
Vс. =
![]() ;
;
![]() =
=
![]() – об’єм,
який взято для титрування
– об’єм,
який взято для титрування
![]() –
середній
об’єм, який затрачено на титрування
–
середній
об’єм, який затрачено на титрування
![]() ;
;
T(HСІ) =
![]() ;
;
К=
. Підпис викладача :___________________
Інструкція до навчальної практики №5
Дата__________________
Тема: Алкаліметрія.
Мета: Закріпити теоретичні знання, набути практичних умінь та навичок проведення хімічного аналізу методом нейтралізації
Література
В.В. Болотов Аналітична хімія X.: Оригінал, 2004, с
Д.Д. Луцевич Аналітична хімія К.: Здоров'я, 2003, с
План.
Стандартизація робочого розчину NaOH за титрованим розчиномHCl.
Визначення вмісту HCl в розчині
Знати:
Характеристику методу за алгоритмом.
Методику проведення кількісного визначення
Уміти:
Провести кількісне визначення досліджуваної речовини у розчині даним методом.
Лабораторна робота
Приготування робочого розчину – NaOH
За приблизно взятою наважкою
|
З фіксаналу |
|
Vвимір.колби (1дм3)
|
f екв.( NaOH) =1; М (NaOH) = 23+16+1= 40 г/моль
|
|
q (NaOH)= 0,1·40·100/1000 = 0,4г |
q(NaOH)= 0,1·40·1дм3 = 4г
|
|
|
C (NaOH) =0,1моль/дм3 |
C (NaOH) =0,1моль/дм3 |
Стандартизація робочого розчину NaOH (за титрованим розчином HCl)
NaOH+ HCl→NaCl + H2O
NaOH
HCl
ф/фталеїн |
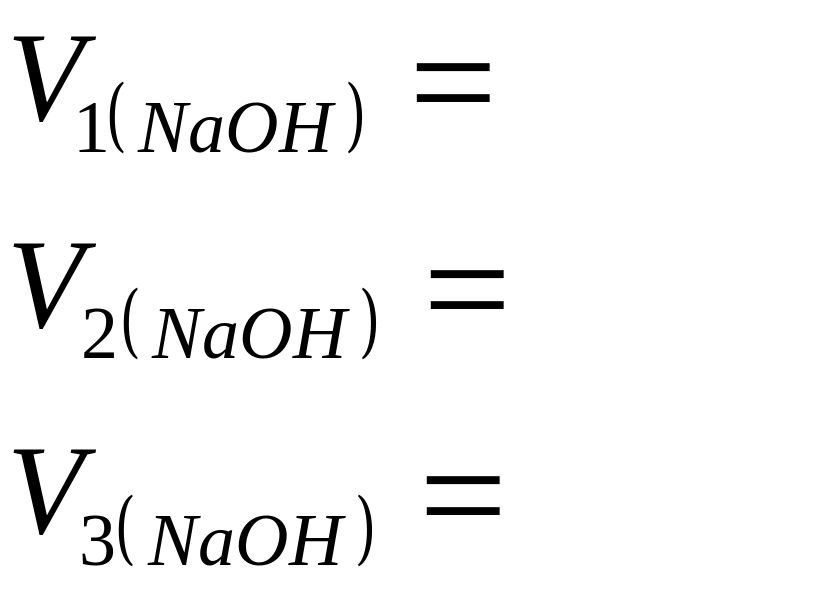
![]() ;
;
![]()
![]() ;
;
![]()
![]() – точний
об’єм,
який взято для титрування
– точний
об’єм,
який взято для титрування
![]() –
середній
об’єм,
який затрачено на титрування
–
середній
об’єм,
який затрачено на титрування
![]() ;
;
T(NaOH) =
![]() ;
;
К![]() =
=


 .
2.
3.
.
2.
3.