
- •Общие указания
- •Глава 1
- •1.1. Органические топлива
- •1.1.1. Состав топлив
- •1.1.2. Характеристики топлив
- •1.1.3. Разновидности горения
- •1.1.4. Основные стадии гетерогенного горения
- •1.1.5. Фазы горения
- •1.1.6. Скорость горения
- •1.2. Расчет процессов горения
- •1.2.1. Определение потребного количества окислителя для полного сжигания 1кг горючего
- •1.2.2. Определение массы воздуха для сжигания 1кг топлива
- •1.2.3. Коэффициент избытка воздуха
- •1.2.4. Определение количества и состава продуктов сгорания
- •1.2.5. Определение состава продуктов сгорания
- •1.2.6. Определение температуры конца сгорания
- •1.2.7. Упрощенная форма уравнения теплового баланса
- •Глава 2
- •2.1. Основные понятия и определения термодинамики
- •2.2. Параметры состояния системы
- •2.3. Первый закон термодинамики
- •2.4. Свойства рv – и Тs – диаграмм
- •2.5. Термодинамические процессы идеальных газов
- •2.5.1. Политропный процесс
- •Вывод уравнения политропного процесса
- •Соотношения между параметрами состояния в политропном процессе
- •Определение изменения внутренней энергии
- •Определение изменения энтальпии
- •Определение изменения энтропии
- •Определение теплоты, подводимой (отводимой) в ходе политропного процесса
- •Определение работы расширения в ходе политропного процесса
- •2.5.2. Частные случаи политропного процесса
- •2.5.3. Изохорный процесс
- •2.5.4. Изобарный процесс
- •2.5.5. Изотермический процесс
- •2.5.6. Адиабатный процесс
- •2.5.7. Графическое изображение процессов
- •2.6. Термодинамические циклы
- •Глава 3
- •3. Реальные газы
- •3.1. Отличия реальных газов от идеальных
- •3.2. Устройство pv – диаграммы реального газа
- •3.3. Области pv- диаграммы
- •3.4. Таблицы водяного пара
- •3.5. Определение параметров влажного насыщенного пара
- •3.6. Диаграммы водяного пара
- •3.7. Расчет процессов изменения состояния реального газа (водяного пара)
- •Изохорный процесс ( )
- •Изобарный процесс ( )
- •Изотермический процесс ( )
- •3.9. Паросиловые установки
- •Глава 4 конвективный теплообмен
- •4.1. Математическая формулировка задачи конвективного теплообмена
- •4.2. Краевые условия при решении задач конвективного теплообмена (условия однозначности)
- •4.3. Решение задач конвективного теплообмена на основе теории подобия
- •4.4. Приведение системы дифференциальных уравнений к безразмерному виду
- •4.5. Теоремы подобия
- •4.6. Физический смысл критериев гидромеханического и теплового подобия
- •4.7. Критериальные уравнения конвективного теплообмена
- •4.8. Методика решения задач конвективного теплообмена на основе теории подобия
- •4.9. Выбор определяющих размеров и величин
- •Семестровая работа №1 топливо, газовые смеси и теплоемкость
- •Указания к выполнению семестровой работы
- •Методика расчета семестровой работы
- •Исходные данные
- •Контрольные вопросы
- •Основная литература
- •Дополнительная литература
- •Семестровая работа №2 термодинамические процессы и циклы с газообразным рабочим телом
- •Указания к выполнению семестровой работы
- •Методика расчета семестровой работы
- •I. Расчет термодинамических процессов, составляющих цикл
- •II. Расчет прямого цикла 1-2-3-4-5-1
- •Контрольные вопросы
- •Основная литература
- •Дополнительная литература
- •Семестровая работа №3 термодинамические процессы водяного пара
- •Указания к выполнению семестровой работы
- •Исходные данные
- •Методика расчета семестровой работы
- •1. Расчет адиабатного процесса 1-2
- •2. Расчет изобарного процесса 2-3
- •3. Расчет процесса 3-4
- •4. Расчет изобарного процесса 4-5
- •5. Расчет изобарного процесса 5-6
- •6. Расчет изобарного процесса 6-1
- •7. Расчет цикла
- •Контрольные вопросы
- •Основная литература
- •Семестровая работа №4 конвективный теплообмен и интенсификация теплопередачи
- •Указания к выполнению семестровой работы
- •Методика расчета семестровой работы № 4
- •1. Определяем коэффициент теплоотдачи
- •2. Определяем коэффициент теплоотдачи
- •3.Определяем термические сопротивления
- •4. Определяем коэффициент теплопередачи
- •5. Вычисляем плотность теплового потока
- •Контрольные вопросы
- •Основная литература
- •Дополнительная литература
- •Приложения
- •Свойства горючих
- •Формулы средних (в интервале 0...Т, к) изохорных массовых
- •Термодинамические свойства пара и воды в состоянии насыщения (по давлению)
- •Термодинамические свойства пара и воды в состоянии насыщения (по давлению)
- •Физические параметры воды на линии насыщения при давлении 101325 Па (760 мм.Рт.Ст.)
- •Физические параметры сухого воздуха при давлении
- •Оглавление
Определение изменения энтропии
Изменение
энтропии в элементарном термодинамическом
процессе по определению выражается
соотношением
![]() .
.
Используя соотношение первого закона термодинамики (2.13), получим
![]() .
.
Из
уравнения состояния идеального газа
следует:
![]() ,
следовательно
,
следовательно
![]() .
(2.33)
.
(2.33)
Интегрируя соотношение (2.33), получим изменение энтропии в конечном процессе от состояния «1» до конечного состояния «2» для 1 кг термодинамической системы:
 .
(2.34)
.
(2.34)
Используя выражение первого закона термодинамики в форме (2.16) и проделав аналогичные преобразования, получим
 .
(2.35)
.
(2.35)
Определение теплоты, подводимой (отводимой) в ходе политропного процесса
Количество
тепла, подводимого (отводимого) в ходе
политропного процесса, можно определить
с помощью уравнения первого закона
термодинамики:
![]() .
.
Сказанное
не исключает возможности определения
dq
с помощью теплоемкости:
или
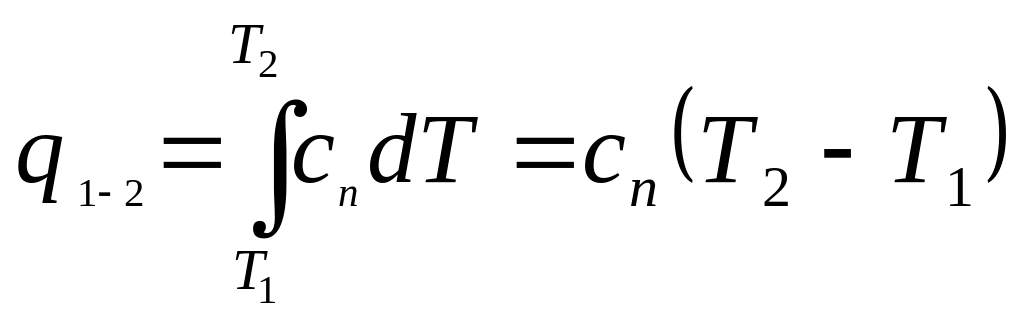 .
.
Используя соотношение (2.19) найдем теплоемкость политропного процесса:
![]() ,
(2.36)
,
(2.36)
где
![]()
![]() показатель
адиабаты.
показатель
адиабаты.
Таким
образом
![]() .
(2.37)
.
(2.37)
Определение работы расширения в ходе политропного процесса
Определим работу расширения в политропном процессе:
 .
(2.38)
.
(2.38)
В
соответствии с основным уравнением
политропы
![]() ,
где p,
v
– текущие значения давления и объема
в ходе процесса.
,
где p,
v
– текущие значения давления и объема
в ходе процесса.
Отсюда ![]() .
(2.39)
.
(2.39)
Совместное решение (2.38) и (2.39) дает:
 или
или
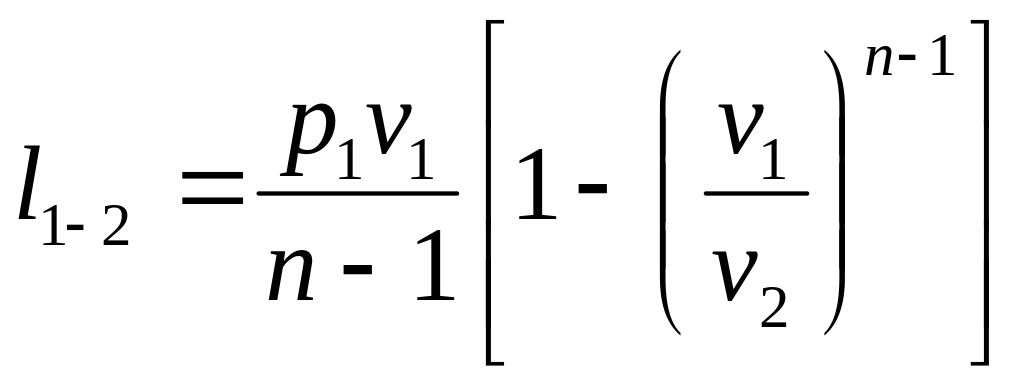 ,
,
![]() .(2.40)
.(2.40)
Для работы идеального газа справедливы следующие выражения:
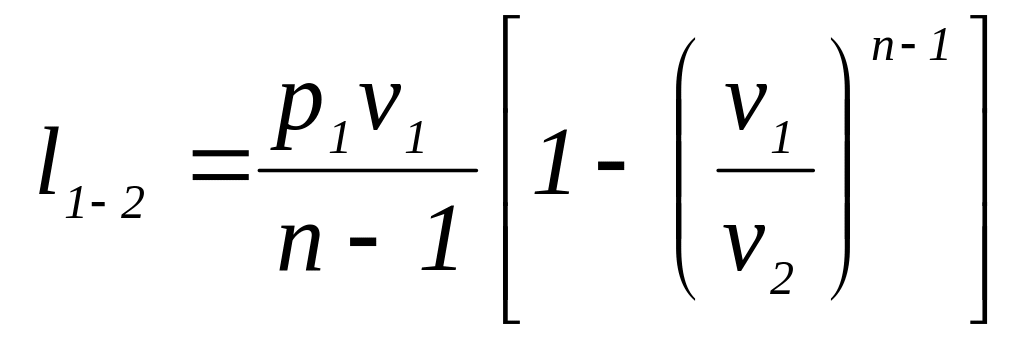 ,
,
![]()
![]() ,
,
 (2.40а)
(2.40а)
2.5.2. Частные случаи политропного процесса
При рассмотрении политропного процесса предполагалось, что все параметры состояния меняются в ходе процесса, что имеет место обмен энергией между системой и окружающей средой. Вместе с тем, существует группа процессов, при протекании которых накладывается ограничение на изменение того или иного параметра состояния, на тот или иной вид энергетического обмена с окружающей средой. Различают четыре вида таких процессов. Это изохорный (v = const), изобарный (р = const), изотермический (T = const) и адиабатный или изоэнтропный (s = const). Рассмотрим эти процессы.
2.5.3. Изохорный процесс
В данном случае постоянен объем (v = const).
Теплоемкость
системы
![]() .
.
Определим значение n при v = const. Из (2.19) следует
![]()
Извлечем
корень n-ой степени из (2.22)
![]()
и
подставим в него найденное значение
показателя политропы. Тогда получим
![]() .
.
Таким
образом, из общего уравнения политропы
получено уравнение изохорного процесса.
Последнее позволяет рассматривать
изохорный процесс как частный случай
политропного процесса при n =
![]() .
.
Определим соотношение между параметрами в изохорном процессе.
Для изохорного процесса имеет смысл искать соотношение лишь между Р и Т, т.к. при v = const поиск взаимосвязи между Р и v или Т и v лишен смысла.
В
общем случае протекания политропного
процесса соотношение Р и Т устанавливалось
(2.26)
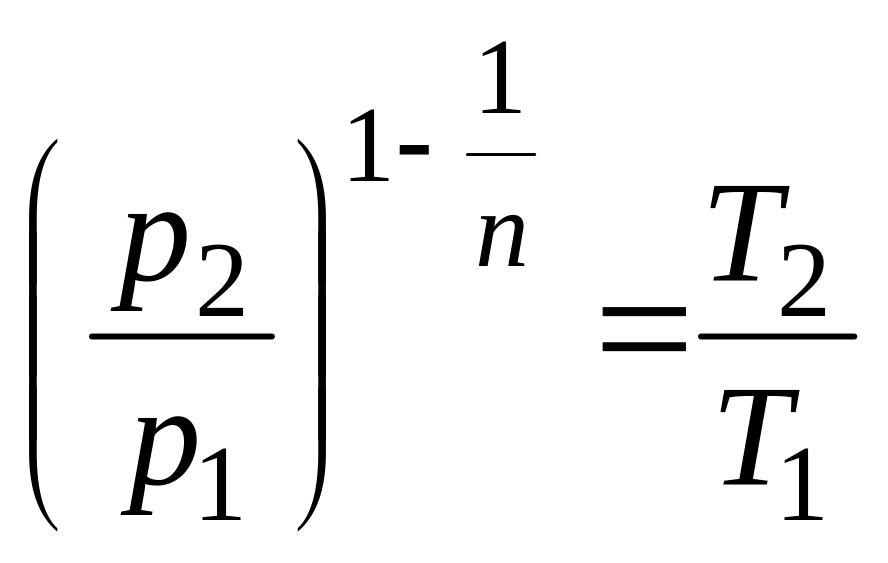 .
.
Если
ввести в него n =
,
то
![]() .
(2.41)
.
(2.41)
Выражение (2.41) известно из физики как закон Шарля.
Изменение
внутренней энергии
![]() .
.
Изменение
энтальпии
![]() .
.
Изменение
энтропии определяется из выражения
(2.34)
![]() .
.
Работа
расширения
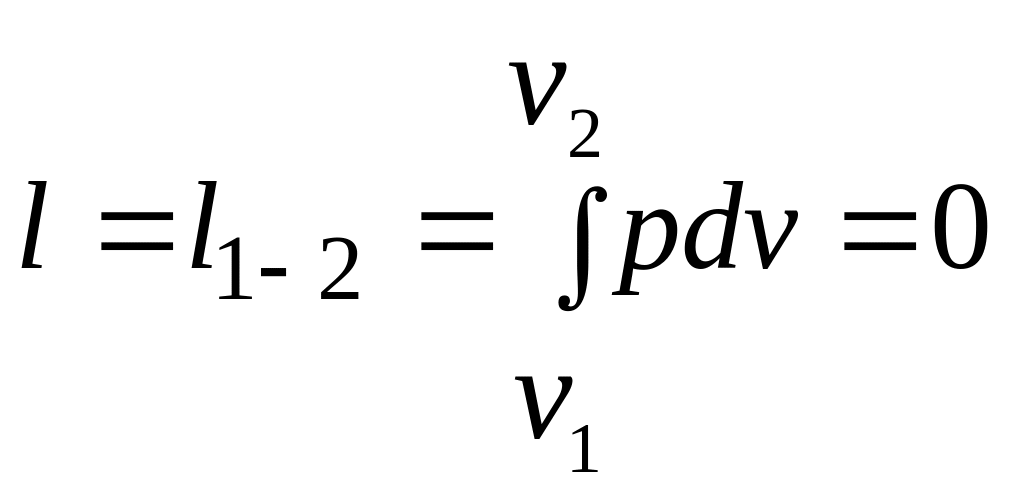 .
.
Из
первого закона термодинамики следует
![]() или
или
![]() .
.
