
- •Міністерство освіти і науки, молоді та спорту україни
- •Методичні рекомендації До виконання лабораторних робіт
- •Основні правила техніки безпеки та організація роботи в лабораторії органічної хімії
- •І.4. Надання першої допомоги
- •2. Обладнання та методи, що застосовуються для проведення хімічних реакцій, виділення та очищення органічних речовин
- •2.1. Методичні вказівки до виконання синтезу органічних речовин
- •2.1.1. Холодильники
- •2.1.2. Перемішувачі
- •2. 2. Нагрівання та охолодження
- •Нагрівання.
- •Охолодження
- •2.3. Виділення та очищення органічних сполук
- •2.3.1.Фільтрування
- •2.3.2. Кристалізація
- •Методика перекристалізації.
- •2.3.3. Сублімація (Возгонка)
- •2.3.4. Висушування
- •Вибір осушника
- •2.3.5. Проста перегонка
- •2. 3. 6. Фракційна перегонка
- •Дефлегмація
- •2.3.7. Перегонка в вакуумі
- •Виконання перегонки
- •2.3.8. Висолювання
- •2.3.9. Екстрагування
- •Екстрагування твердих речовин.
- •Екстрагування рідин
- •Екстрагування рідин із розчинів або суспензій.
- •3. Методичні рекомендації до написання дкр
- •3.1. Рекомендації до складання плану дкр
- •Критерії оцінювання якості дкр викладачем
- •3.4.Приблизний перелік тем для дкр:
- •Джерела хімічної інформації
- •Література.
- •Міністерство освіти і науки, молоді та спорту україни
Виконання перегонки
Для виконання перегонки збирають прилад, як показано на мал.13. Для перевірки герметичності включають вакуум і спостерігають за
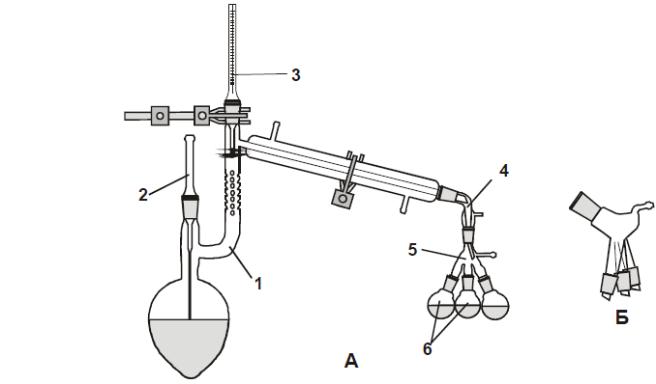
Малюнок 14. А - Прилад для перегонки; 1- колба Кляйзена з холодильником, 2 – капіляр, 3 – термометр, 4 –алонж, 5 – «павук», Б – алонж «павук».
показаннями манометра. Якщо прилад справний, знімають вакуум і наливають в перегонну колбу рідину для перегонки. Зважують рідину в перегонній колбі та приймачі, щоб після закінчення роботи по вазі фракцій, залишку і загрузки скласти кількісний баланс перегонки. При перегонці спочатку відрегульовують необхідний вакуум і тільки потім приступають до нагрівання колби, швидкість перегонки вибирають такою, щоб за секунду стікало не більше 1-2 крапель дистилату. При перегонці весь час слідкують за температурою і при зміні її повертають «павук», збираючи окремі фракції. В лабораторному журналі записують температуру кипіння кожної фракції і тиск, при якому здійснюється перегонка, якщо речовина чиста, то основна фракція переганяється при майже постійній температурі. В кінці відгонки фракції температура зростає на І-2°С, оскільки відбувається перегрів. Якщо рідина переганялась в ширшому інтервалі температур, то перегонку варто повторити на ректифікаційній колонці.
Після закінчення перегонки.припиняють нагрів, охолоджують прилад і обережно зменшують вакуум. Потім зважують фракції і залишок в перегонній колбі. При будь–якій вакуумній перегонці необхідно одягати захисні окуляри або користуватись маскою з прозорого негорючого матеріалу.
2.3.8. Висолювання
Висолювання - це спосіб виділення органічних речовин із водних розчинів шляхом зниження їх розчинності при насиченні цього розчину мінеральними солями.
Розглядают два випадки висолювання:
а) Розчинність здатних до дисоціації речовин можна зменшити, додаючи сіль з однойменним іоном, при цьому відбувається зсув рівноваги дисоціації в сторону недисоційованої соли, яка випадає в осад, як тільки розчин стає пересиченим.
б) При розчиненні у воді багатьох речовин - аніліну, білку та інших органічних сполук, які містять гідрофільні групи, молекули води утворюють навколо молекули органічної речовини гідратну (сольватну) оболочку, що й створює умови для переходу цієї речовини в розчин. При додаванні солей ( NaCl, CaCl2 ) іони, що утворюються при їх дисоціації, більш енергійно зв’язують молекули води, і тим самим знімають . гідратну оболонку з молекули органічної речовини. Речовина втрачає здатність розчинятися. Найбільший ефект висолювання спостерігається для насичених розчинів. Для висолювання хлород натрію подрібнюють і додають до дистидяту (розчин, який висолюють) з розрахунку 35г солі на 100 г розчину. Струшують та за допомогою ділільної лійки відділяють органічний шар або екстрагують органічну речовину декілька разів органічним розчинником, який не змішується з водою.
2.3.9. Екстрагування
Екстрагування – це метод вилучення речовини із суміші за допомогою розчинника. Цей метод грунтується на законі Нернста – законі розподілу речовин між рідкими фазами А і В, що не змішуються. Згідно цього закону константа розподілу речовин між двома рідкими фазами при певній температурі є величиною сталою.
К = СА/СВ
Якщо в ідеальних умовах різниця між К1 і К2 для двох речовин досить велика, то такі речовини можна розділити методом екстрагування. Так, якщо β = К1/К2 – фактор розподілу між фазами дорівнює 100 або більше, то такі речовини розділяються задовільно простою екстракцією. На практиці найчастіше проводять ексрагування два – три рази.
Розрізняють два типи екстракції: екстрагування твердих речовин та екстрагування рідин. В залежності від того, що використовують як розчинник, розрізняють екстракцію водою або водними розчинами, органічними розчинниками і розплавами.
