
- •Тверской государственный технический университет в.И. Луцик, а.Е. Соболев, ю.В. Чурсанов физико-химические методы анализа
- •Предисловие
- •Классификация физико-химических методов анализа
- •Метрологические характеристики и статистическая обработка результатов анализа
- •1. Спектральные и оптические методы анализа
- •1.1. Эмиссионный спектральный анализ. Фотометрия пламени
- •1.2. Атомно-абсорбционный анализ
- •1.3. Молекулярно-абсорбционный анализ
- •Метода дифференциальной фотометрии
- •1.3.3. Фотометрическое титрование
- •1.4. Фотометрия светорассеивающих систем
- •1.5. Люминесцентный анализ
- •1.6. Другие оптические методы
- •2. Электрохимические методы анализа
- •2.1. Электрогравиметрия
- •2.1.1. Электродные реакции
- •2.1.2. Электролиз с контролируемым током
- •2.1.3. Электролиз с контролируемым потенциалом
- •2.1.4. Выход по току
- •2.1.5. Электрогравиметрическое определение меди (работа № 10)
- •2.2. Потенциометрия
- •2.2.1. Потенциометрическая ячейка
- •2.2.2. Типы индикаторных электродов в потенциометрии
- •2.2.3. Типы ион-селективных электродов
- •2.2.4. Прямая потенциометрия
- •2.2.5. Потенциометрическое титрование
- •2.2.6. Потенциометрическое определение хлорид-ионов (работа № 11)
- •2.2.7. Определение концентрации фторид-ионов (работа № 12)
- •2.2.8. Потенциометрическое опреление рН и жесткости воды (работа № 13)
- •2.2.9. Определение концентрации хлороводородной и борной кислот методом потенциометрического титрования (работа № 14)
- •2.2.10. Определение концентрации анилина методом потенциометри-ческого титрования (работа № 15)
- •2.3. Кондуктометрический анализ
- •2.3.1. Электрическая проводимость растворов
- •2.3.2. Методы измерения электрической проводимости
- •2.3.3. Прямая кондуктометрия
- •2.3.4. Кондуктометрическое титрование
- •2.3.5. Кондуктометрическое титрование смеси хлороводородной и уксусной кислот (работа № 16)
- •2.3.6. Определение концентрации серной кислоты и сульфата меди методом кондуктометрического титрования (работа № 17)
- •2.4. Полярографический анализ
- •2.4.1. Постояннотоковая (классическая) полярография
- •2.4.2. Вольтамперометрия с линейной разверткой потенциала на стационарных электродах
- •2.4.3. Переменнотоковая полярография
- •2.4.4. Дифференциально-импульсная полярография
- •2.4.5. Амперометрия и амперометрическое титрование
- •2.4.6. Полярографическое определение меди и никеля при совместном присутствии (работа № 18)
- •2.4.7. Амперометрическое определение кадмия (работа № 19)
- •3. Хроматографические методы анализа
- •3.1. Введение в хроматографию
- •3.2. Классификация хроматографических методов анализа
- •3.3. Жидкостная ионообменная хроматография
- •3.4. Плоскостная жидкостная распределительная хроматография
- •3.5. Газовая хроматография
- •4. Термические методы анализа
- •4.1. Общая характеристика методов
- •4.2. Дериватография
- •4.3. Термогравиметрическое определение кальция в виде оксалата (работа № 27)
- •Библиографический список
- •Приложения
- •Организация экспериментальной работы студентов
- •Требования, предъявляемые для допуска к лабораторной работе
- •Порядок выполнения лабораторных работ
- •Требования к оформлению лабораторного отчета
- •Содержание отчета о лабораторной работе
- •Порядок защиты результатов лабораторных работ
- •Статистическая обработка результатов анализа Статистическая обработка градуировочной зависимости
- •Порядок вычисления погрешности и представление аналитических данных
- •Определение точки эквивалентности по кривой титрования
- •Приложение 4 Порядок проведения измерений на приборах, используемых в нескольких лабораторных работах Проведение измерений на потенциометре рН-340
- •Проведение измерений на иономере и-160ми
- •Проведение измерений на иономере эв-74
- •Проведение измерений на рН-метре-милливольтметре рН-410
- •Справочные таблицы Стандартные буферные растворы для рН-метрии
- •Стандартные электродные потенциалы в водных растворах при 25 оС
- •Предельная эквивалентная электрическая проводимость ионов при 25 оС
- •Фотометрия пламени
- •Вопросы зачетного коллоквиума по курсу фхма
- •170026 Г. Тверь, наб. А. Никитина, 22
Порядок защиты результатов лабораторных работ
К защите каждым студентом предъявляется полностью оформлен-ный лабораторный отчет, содержащий сверенный с истинным результат и статистическую обработку.
При защите обсуждаются теоретические основы метода, его конкрет-ное воплощение в применяемой методике. Обсуждение ведется в соответ-ствии с контрольными вопросами, предложенными в методических указа-ниях к лабораторной работе.
В программу защиты входит решение расчетной задачи на обсужда-емую тему из типового сборника по курсу ФХМА.
После получения условия задачи и конкретных контрольных вопро-сов студент имеет время в пределах 0,5 ч для решения задачи и подготовки к ответу.
Приложение 2
Статистическая обработка результатов анализа Статистическая обработка градуировочной зависимости
Если градуировочная функция является прямой, выходящей не из начала координат, то градуировочная модель выражается уравнением
![]()
где b0 – сигнал фона; b1 – коэффициент чувствительности. Коэффициенты b0 и b1 можно вычислить методом наименьших квадратов:
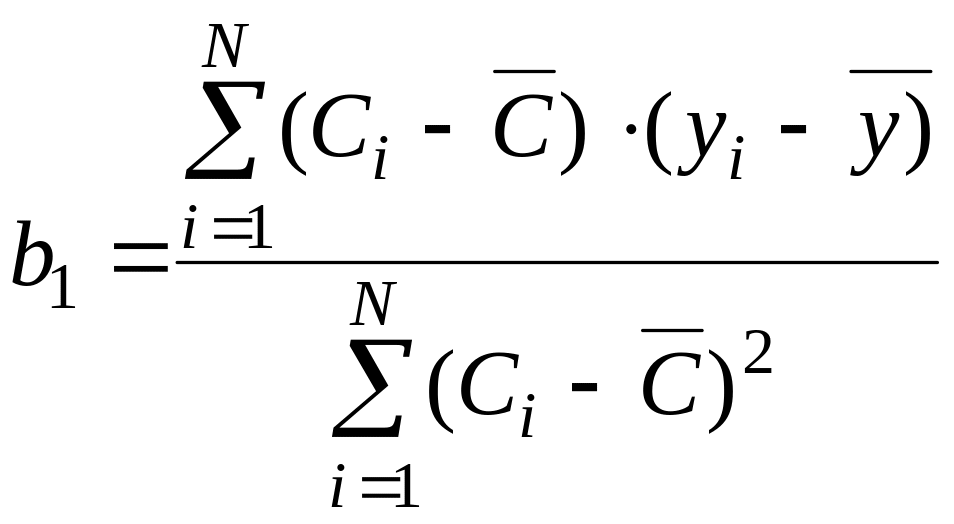 ,
,
![]() ,
,
где
![]() и
и
![]() – средние арифметические из всех
значений концентраций (Сi)
образцов сравнения, используемых для
градуировки, и соответствующих им
аналитических сигналов (yi);
N – число образцов
сравнения. Качество градуировочной
модели можно оценить с помощью остаточного
стандарт-ного отклонения:
– средние арифметические из всех
значений концентраций (Сi)
образцов сравнения, используемых для
градуировки, и соответствующих им
аналитических сигналов (yi);
N – число образцов
сравнения. Качество градуировочной
модели можно оценить с помощью остаточного
стандарт-ного отклонения:
![]() ,
,
где
![]() ,
а
,
а
![]() – невязка между экспериментальной и
расчетной величинами аналитического
сигнала в градуировочной зависи-мости.
Величина sy
имеет размерность аналитического
сигнала, поэтому удобнее пользоваться
стандартным отклонением методики sc,
которое имеет размерность концентрации:
– невязка между экспериментальной и
расчетной величинами аналитического
сигнала в градуировочной зависи-мости.
Величина sy
имеет размерность аналитического
сигнала, поэтому удобнее пользоваться
стандартным отклонением методики sc,
которое имеет размерность концентрации:
![]() .
.
Приведенные расчеты справедливы при выполнении условий:
1. Погрешности при приготовлении образцов сравнения значительно меньше погрешностей измерения.
2. Все результаты измерений статистически независимы.
3. Все результаты измерений имеют одно и то же стандартное откло-нение, не зависящее от концентрации и величины аналитического сигнала.
4. Все результаты измерений распределены по нормальному закону.
Очень часто нарушается условие 3. В этом случае при построении градуировочного графика необходимо уменьшить диапазон концентраций или строить градуировочные зависимости раздельно в области малых и больших концентраций.
При выполнении всех условий для определения концентрации вещества можно пользоваться формулой, обратной аналитическому выражению градуировочной модели:
![]()
Качество калибровочной модели оценивают путем расчета доверительного интервала:
 ,
,
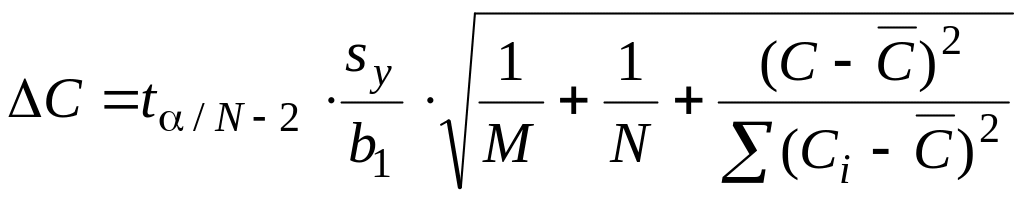 ,
,
где t – коэффициент Стьюдента; – среднее арифметическое из концен-траций всех образцов сравнения; N – число образцов сравнения; М – число параллельных определений данной концентрации.
Пример. Для определения концентрации серебра фотоколориметри-ческим методом построена градуировочная зависимость оптической плот-ности A от концентрации серебра С (мг/см3). Градуировочная зависимость содержит 7 точек, результаты приведены в табл. П.1.
Проведена серия анализов раствора неизвестной концентрации, со-стоящая из трех параллельных определений. Оптические плотности равны: A1 = 0,522; A2 = 0,512; A3 = 0,534. Рассчитать неизвестную концентрацию серебра в растворе, пользуясь градуировочной зависимостью. Определить доверительный интервал для полученной величины.
Решение:
= 0,5143;
![]() =
0,4569.
=
0,4569.
Градуировочная зависимость (рис. П.1)
![]() ,
sy
= 0,0085, sc
= 0,0097 мг/см3.
,
sy
= 0,0085, sc
= 0,0097 мг/см3.
Таблица П.1
Градуировочная зависимость оптической плотности от концентрации при фотоколориметрическом определении серебра с n-диметиламинобензилиденроданином ( = 450 нм; длина кюветы 1 см; стандартный раствор 1000 мг/см3; рабочий раствор 10 мг/см3)
N |
Сi, мг/см3 |
yi (А) |
yрасч |
|
|
|
|
1 |
0,100 |
0,086 |
0,0939 |
-0,00793 |
0,153640816 |
0,171632653 |
6,29E-05 |
2 |
0,300 |
0,269 |
0,2691 |
-0,00013 |
0,040255102 |
0,045918367 |
1,69E-08 |
3 |
0,500 |
0,445 |
0,4443 |
0,00067 |
0,000169388 |
0,000204082 |
4,49E-07 |
4 |
0,500 |
0,452 |
0,4443 |
0,00767 |
0,000069389 |
0,000204082 |
5,88E-05 |
5 |
0,600 |
0,538 |
0,5319 |
0,00607 |
0,006955102 |
0,007346939 |
3,68E-05 |
6 |
0,700 |
0,626 |
0,6195 |
0,00647 |
0,031412245 |
0,034489796 |
4,19E-05 |
7 |
0,900 |
0,782 |
0,7947 |
-0,01273 |
0,125412245 |
0,148775510 |
1,62E-04 |
|
|
3,198 |
|
|
= 0,357914286 |
= 0,40857143 |
= 0,000363 |
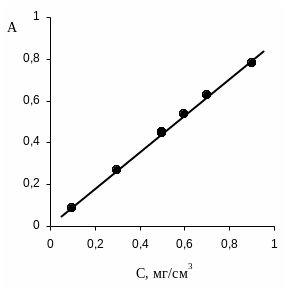
Рис. П.1. Градуировочная зависимость оптической плотности от концентрации
Из серии параллельных
![]() =
0,5227, из градуировочной зависимости
C
= 0,589 мг/см3;
=
0,5227, из градуировочной зависимости
C
= 0,589 мг/см3;
![]() =
0,07513.
=
0,07513.
Используя данные табл. П.2, вычислим доверительный интервал.
Таблица П.2
Данные для расчета доверительного интервала
N |
|
1 |
0,171633 |
2 |
0,045918 |
3 |
0,000204 |
4 |
0,000204 |
5 |
0,007347 |
6 |
0,034490 |
7 |
0,148776 |
|
|
Из табл. П.3 коэффициент Стьюдента t 0,95, 2 = 4,30.
![]() 0,035 мг/см3.
0,035 мг/см3.
Таким образом, результат определения концентрации серебра
![]() мг/см3.
мг/см3.
Таблица П.3
Коэффициенты Стьюдента
![]()
α |
n |
|||||||||
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
15 |
|
0,70 |
2,0 |
1,3 |
1,3 |
1,2 |
1,2 |
1,1 |
1,1 |
1,1 |
1,1 |
1,1 |
0,95 |
12,7 |
4,3 |
3,2 |
2,8 |
2,6 |
2,4 |
2,4 |
2,3 |
2,3 |
2,1 |
0,99 |
63,7 |
9,9 |
5,8 |
4,6 |
4,0 |
3,7 |
3,5 |
3,4 |
3,3 |
3,0 |
