
- •Тверской государственный технический университет в.И. Луцик, а.Е. Соболев, ю.В. Чурсанов физико-химические методы анализа
- •Предисловие
- •Классификация физико-химических методов анализа
- •Метрологические характеристики и статистическая обработка результатов анализа
- •1. Спектральные и оптические методы анализа
- •1.1. Эмиссионный спектральный анализ. Фотометрия пламени
- •1.2. Атомно-абсорбционный анализ
- •1.3. Молекулярно-абсорбционный анализ
- •Метода дифференциальной фотометрии
- •1.3.3. Фотометрическое титрование
- •1.4. Фотометрия светорассеивающих систем
- •1.5. Люминесцентный анализ
- •1.6. Другие оптические методы
- •2. Электрохимические методы анализа
- •2.1. Электрогравиметрия
- •2.1.1. Электродные реакции
- •2.1.2. Электролиз с контролируемым током
- •2.1.3. Электролиз с контролируемым потенциалом
- •2.1.4. Выход по току
- •2.1.5. Электрогравиметрическое определение меди (работа № 10)
- •2.2. Потенциометрия
- •2.2.1. Потенциометрическая ячейка
- •2.2.2. Типы индикаторных электродов в потенциометрии
- •2.2.3. Типы ион-селективных электродов
- •2.2.4. Прямая потенциометрия
- •2.2.5. Потенциометрическое титрование
- •2.2.6. Потенциометрическое определение хлорид-ионов (работа № 11)
- •2.2.7. Определение концентрации фторид-ионов (работа № 12)
- •2.2.8. Потенциометрическое опреление рН и жесткости воды (работа № 13)
- •2.2.9. Определение концентрации хлороводородной и борной кислот методом потенциометрического титрования (работа № 14)
- •2.2.10. Определение концентрации анилина методом потенциометри-ческого титрования (работа № 15)
- •2.3. Кондуктометрический анализ
- •2.3.1. Электрическая проводимость растворов
- •2.3.2. Методы измерения электрической проводимости
- •2.3.3. Прямая кондуктометрия
- •2.3.4. Кондуктометрическое титрование
- •2.3.5. Кондуктометрическое титрование смеси хлороводородной и уксусной кислот (работа № 16)
- •2.3.6. Определение концентрации серной кислоты и сульфата меди методом кондуктометрического титрования (работа № 17)
- •2.4. Полярографический анализ
- •2.4.1. Постояннотоковая (классическая) полярография
- •2.4.2. Вольтамперометрия с линейной разверткой потенциала на стационарных электродах
- •2.4.3. Переменнотоковая полярография
- •2.4.4. Дифференциально-импульсная полярография
- •2.4.5. Амперометрия и амперометрическое титрование
- •2.4.6. Полярографическое определение меди и никеля при совместном присутствии (работа № 18)
- •2.4.7. Амперометрическое определение кадмия (работа № 19)
- •3. Хроматографические методы анализа
- •3.1. Введение в хроматографию
- •3.2. Классификация хроматографических методов анализа
- •3.3. Жидкостная ионообменная хроматография
- •3.4. Плоскостная жидкостная распределительная хроматография
- •3.5. Газовая хроматография
- •4. Термические методы анализа
- •4.1. Общая характеристика методов
- •4.2. Дериватография
- •4.3. Термогравиметрическое определение кальция в виде оксалата (работа № 27)
- •Библиографический список
- •Приложения
- •Организация экспериментальной работы студентов
- •Требования, предъявляемые для допуска к лабораторной работе
- •Порядок выполнения лабораторных работ
- •Требования к оформлению лабораторного отчета
- •Содержание отчета о лабораторной работе
- •Порядок защиты результатов лабораторных работ
- •Статистическая обработка результатов анализа Статистическая обработка градуировочной зависимости
- •Порядок вычисления погрешности и представление аналитических данных
- •Определение точки эквивалентности по кривой титрования
- •Приложение 4 Порядок проведения измерений на приборах, используемых в нескольких лабораторных работах Проведение измерений на потенциометре рН-340
- •Проведение измерений на иономере и-160ми
- •Проведение измерений на иономере эв-74
- •Проведение измерений на рН-метре-милливольтметре рН-410
- •Справочные таблицы Стандартные буферные растворы для рН-метрии
- •Стандартные электродные потенциалы в водных растворах при 25 оС
- •Предельная эквивалентная электрическая проводимость ионов при 25 оС
- •Фотометрия пламени
- •Вопросы зачетного коллоквиума по курсу фхма
- •170026 Г. Тверь, наб. А. Никитина, 22
4.2. Дериватография
Наиболее распространенным методом термического анализа, осно-ванным на одновременном построении и последующей интерпретации кривых ТГ, ДТГ, ДТА и Т (температуры образца), является дериватогра-фия. Приборы, используемые в дериватографии, называются дериватогра-фами. Применяемый в настоящем лабораторном практикуме дериватограф Q-1500 фирмы МОМ имеет блок питания; программатор, задающий ско-рость изменения температуры образца; блок печей (две цилиндрические печи); блок весов и шестиканальный самописец (используются 4 канала).
На рис. 4.2 изображена дериватограмма СаС2О4 · H2О.
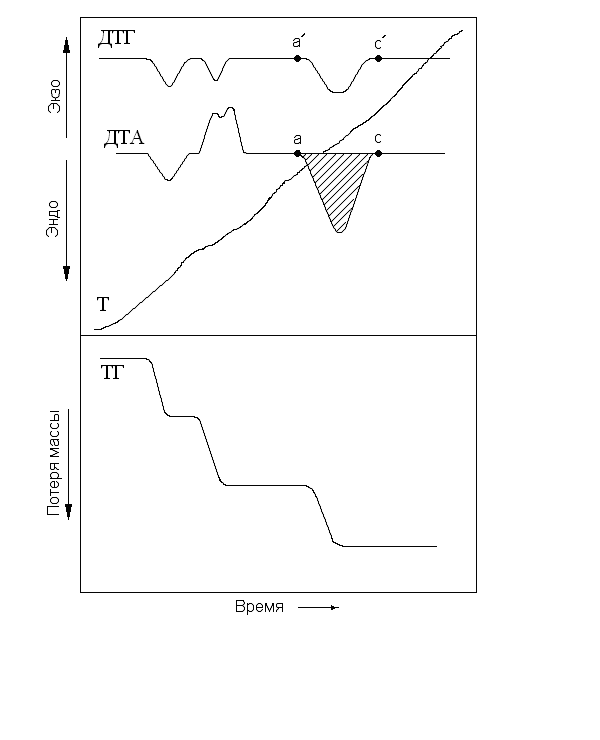
Рис. 4.2. Дериватограмма СaС2О4 · Н2О. Условия записи: m = 900 мг;
чувствительность 1000 мг; Т = 1000 оС; скорость нагрева – 10 К/мин;
скорость движения диаграммной ленты – 2 мм/мин; ДТА – 500 мB;
ДТГ – 2,5 мВ; тигель керамический; среда – воздух
Кривая Т имеет прямолинейный характер, несколько искаженный в местах, соответствующих значительным экзо- или эндотермическим эффектам в образце. Нанесенные шкалы температуры на кривую Т проводят с использованием специального планшета.
Кривая ДТА имеет отклонения от горизонтали, соответствующие экзо- (вверх) и эндоэффектам (вниз) процессов, протекающих в образце. По этой кривой можно оценить количество активной фазы (подверга-ющейся превращению). Оценка основана на изменении энтальпии образца ΔН и разности температур ΔТ между ним и инертным веществом (Al2O3):
![]() ,
(4.1)
,
(4.1)
где m – масса активного вещества; k – теплопроводность пробы; g – по-стоянная прибора. Величина интеграла соответствует площади, ограничен-ной линией экстремума на кривой ДТА и базовой линией ас (см. рис. 4.2, заштрихованный участок). Имея ранее записанную в одинаковых условиях кривую ДТА для чистого образца известной массы, можно по площади пиков рассчитать массу активного вещества, воспользовавшись преобразо-ванием на основе уравнения (4.1):
 ,
кДж/моль.
,
кДж/моль.
Поскольку для одного и того же превращения ΔН = const , то
![]()
и
![]() .
.
Величина S1 / S0 соответствует отношению масс копий соответству-ющих пиков, вырезанных из кальки (взвешивают на аналитических весах). Относительная ошибка этого метода составляет 5 – 10 %. Метод незаменим для случаев, когда образец не изменяет массу в ходе превращений.
Кривая ТГ отражает изменение массы образцов в ходе термических превращений и имеет вид ступеней. Она позволяет наиболее точно опреде-лить изменение массы образца. Для ее расшифровки надо знать массу активного вещества и заданную чувствительность прибора (соответствует полной ширине диаграммной ленты). Если взять массу образца и чувстви-тельность прибора равными 500 мг, то, измерив высоту соответствующей ступеньки на кривой и отнеся ее к ширине диаграммной ленты, можно получить долю массы образца, которую он потерял (если речь идет о дегидратации или разложении вещества) в данной превращении.
Кривая ДТГ позволяет более точно отметить точку начала и конца превращения, связанного с изменением массы образца (рис. 4.2, точки a' и с'), чем это возможно по кривой ТГ или ДТА.
Отнесение любой точки на кривых ДТА, TГ и ДТГ к соответствую-щей температуре проводят путем опускания вертикалей из выбранных точек до пересечения их с кривой Т.
