
- •Тверской государственный технический университет в.И. Луцик, а.Е. Соболев, ю.В. Чурсанов физико-химические методы анализа
- •Предисловие
- •Классификация физико-химических методов анализа
- •Метрологические характеристики и статистическая обработка результатов анализа
- •1. Спектральные и оптические методы анализа
- •1.1. Эмиссионный спектральный анализ. Фотометрия пламени
- •1.2. Атомно-абсорбционный анализ
- •1.3. Молекулярно-абсорбционный анализ
- •Метода дифференциальной фотометрии
- •1.3.3. Фотометрическое титрование
- •1.4. Фотометрия светорассеивающих систем
- •1.5. Люминесцентный анализ
- •1.6. Другие оптические методы
- •2. Электрохимические методы анализа
- •2.1. Электрогравиметрия
- •2.1.1. Электродные реакции
- •2.1.2. Электролиз с контролируемым током
- •2.1.3. Электролиз с контролируемым потенциалом
- •2.1.4. Выход по току
- •2.1.5. Электрогравиметрическое определение меди (работа № 10)
- •2.2. Потенциометрия
- •2.2.1. Потенциометрическая ячейка
- •2.2.2. Типы индикаторных электродов в потенциометрии
- •2.2.3. Типы ион-селективных электродов
- •2.2.4. Прямая потенциометрия
- •2.2.5. Потенциометрическое титрование
- •2.2.6. Потенциометрическое определение хлорид-ионов (работа № 11)
- •2.2.7. Определение концентрации фторид-ионов (работа № 12)
- •2.2.8. Потенциометрическое опреление рН и жесткости воды (работа № 13)
- •2.2.9. Определение концентрации хлороводородной и борной кислот методом потенциометрического титрования (работа № 14)
- •2.2.10. Определение концентрации анилина методом потенциометри-ческого титрования (работа № 15)
- •2.3. Кондуктометрический анализ
- •2.3.1. Электрическая проводимость растворов
- •2.3.2. Методы измерения электрической проводимости
- •2.3.3. Прямая кондуктометрия
- •2.3.4. Кондуктометрическое титрование
- •2.3.5. Кондуктометрическое титрование смеси хлороводородной и уксусной кислот (работа № 16)
- •2.3.6. Определение концентрации серной кислоты и сульфата меди методом кондуктометрического титрования (работа № 17)
- •2.4. Полярографический анализ
- •2.4.1. Постояннотоковая (классическая) полярография
- •2.4.2. Вольтамперометрия с линейной разверткой потенциала на стационарных электродах
- •2.4.3. Переменнотоковая полярография
- •2.4.4. Дифференциально-импульсная полярография
- •2.4.5. Амперометрия и амперометрическое титрование
- •2.4.6. Полярографическое определение меди и никеля при совместном присутствии (работа № 18)
- •2.4.7. Амперометрическое определение кадмия (работа № 19)
- •3. Хроматографические методы анализа
- •3.1. Введение в хроматографию
- •3.2. Классификация хроматографических методов анализа
- •3.3. Жидкостная ионообменная хроматография
- •3.4. Плоскостная жидкостная распределительная хроматография
- •3.5. Газовая хроматография
- •4. Термические методы анализа
- •4.1. Общая характеристика методов
- •4.2. Дериватография
- •4.3. Термогравиметрическое определение кальция в виде оксалата (работа № 27)
- •Библиографический список
- •Приложения
- •Организация экспериментальной работы студентов
- •Требования, предъявляемые для допуска к лабораторной работе
- •Порядок выполнения лабораторных работ
- •Требования к оформлению лабораторного отчета
- •Содержание отчета о лабораторной работе
- •Порядок защиты результатов лабораторных работ
- •Статистическая обработка результатов анализа Статистическая обработка градуировочной зависимости
- •Порядок вычисления погрешности и представление аналитических данных
- •Определение точки эквивалентности по кривой титрования
- •Приложение 4 Порядок проведения измерений на приборах, используемых в нескольких лабораторных работах Проведение измерений на потенциометре рН-340
- •Проведение измерений на иономере и-160ми
- •Проведение измерений на иономере эв-74
- •Проведение измерений на рН-метре-милливольтметре рН-410
- •Справочные таблицы Стандартные буферные растворы для рН-метрии
- •Стандартные электродные потенциалы в водных растворах при 25 оС
- •Предельная эквивалентная электрическая проводимость ионов при 25 оС
- •Фотометрия пламени
- •Вопросы зачетного коллоквиума по курсу фхма
- •170026 Г. Тверь, наб. А. Никитина, 22
2.2.7. Определение концентрации фторид-ионов (работа № 12)
Цель работы: определение концентрации фторид-ионов в растворе с помощью ионоселективного электрода.
Сущность метода. В основе метода лежит использование ион-селективного твердофазного электрода. Фторидный электрод – один из самых важных электродов с кристаллической мембраной, поскольку существует всего несколько методов, пригодных для простого и селективного определения фторидов. Электродная мембрана состоит из пластинки монокристалла LaF3 с добавками Eu(II) для повышения электро-проводности мембраны. Электродная функция основана на селективной адсорбции фторид-ионов на поверхности электрода, приводящей к разделению зарядов; электропроводность мембраны обусловлена только подвижностью фторид-ионов. Внутренний раствор содержит 0,1 М NaF и 0,1 М NaCl, в него погружен хлоридсеребряный электрод.
Электродная функция выполняется в диапазоне 10–1 – 10–6 М фторид-ионов. Единственный мешающий ион – ОН–, поскольку он может участ-вовать в реакции обмена на поверхности мембраны:
LaF3 + 3 ОН– La(OH)3 + 3 F–.
При высоких значениях
рН образуется слой La(OH)3,
поскольку раствори-мость La(OH)3
и LaF3 примерно
одинакова. Потенциометрический
коэффи-циент селективности
![]() =
0,1, в то время как селективность электрода
к фторид-иону в присутствии других
анионов на несколько порядков выше.
=
0,1, в то время как селективность электрода
к фторид-иону в присутствии других
анионов на несколько порядков выше.
Известно, что ионы Н+ реагируют с фторид-ионами с образованием HF и HF2–:
H+ + 2 F– HF + F– HF2–,
не определяемых электродом. Поэтому если понизить рН анализируемого раствора, уменьшается концентрация свободного фторид-иона и потенциал электрода повышается. Рабочий диапазон рН фторидного электрода лежит в интервале 5,5 – 6,5, создаваемом ацетатным или цитратным буфером.
Ионы А13+ и Fe3+ уменьшают содержание свободных фторид-ионов в растворе вследствие комплексообразования. Если необходимо определить общее содержание ионов F–, следует добавить лиганд, образующий более устойчивые комплексы с этими катионами и высвобождающий фторид-ионы. Такими лигандами могут быть цитрат или этилендиаминтетрауксус-ная кислота (ЭДТА). Следовательно, правильный выбор условий измерения позволяет устранить влияние рН и таких комплексообразова-телей, как А13+ и Fe3+.
Оборудование: 1) иономер универсальный; 2) электроды: фторид-ный (индикаторный), хлоридсеребряный (сравнения); 3) термокомпенса-тор; 4) штатив лабораторный; 5) стаканчики полиэтиленовые на 50 см3 – 5 шт.; 6) стакан для слива; 7) промывалка; 8) фильтровальная бумага; 9) бюретки на 50 см3 для растворов NaF – 5 шт.; 10) бюретка на 50 см3 для буферного раствора; 11) мерные колбы на 100 см3 – 4 шт.; 12) мерная колба на 500 см3 для приготовления буферного раствора БРОИС (буфер-ный раствор общей ионной силы).
Реактивы: 1) 0,1 М раствора фторида натрия; 2) ацетат натрия; 3) хлорид натрия; 4) цитрат натрия; 5) стандартный раствор динатриевой соли этилендиаминтетрауксусной кислоты (ЭДТА); 6) концентрированная уксусная кислота (ледяная).
Ход работы. Приготовление растворов фторида натрия. 0,1 М – в мерную колбу на 1 дм3 помещают 4,1990 г высушенного при 105 °С (до постоянной массы) фторида натрия. Растворяют навеску и доводят объем водой до метки.
0,01 М – берут 10,00 см3 приготовленного стандартного 0,1 М раствора и разбавляют до 100 см3 дистиллированной водой в мерной колбе.
0,001 М – готовят из 0,01 М раствора. Берут 10,00 см3 и разбавляют дистиллированной водой до метки в колбе на 100 см3.
0,0001 М – готовят из 0,001 М раствора. Отмеряют пипеткой 10,00 см3 указанного раствора и разбавляют в мерной колбе водой до объема 100 см3.
0,00001 М – отбирают пипеткой 10,00 см3 0,0001 М раствора, переносят в мерную колбу на 100 см3 и разбавляют водой до метки.
Приготовление ацетатно-цитратного буферного раствора. В мерную колбу на 500 см3 помещают 52,0 г ацетата натрия, 29,2 г хлорида натрия, 3,0 г цитрата натрия, 0,3 г динатриевой соли этилендиаминтетра-уксусной кислоты (ЭДТА), 8,0 см3 ледяной уксусной кислоты и приливают 200 – 300 см3 дистиллированной воды. После растворения компонентов доводят объем раствора до метки дистиллированной водой.
Построение градуировочного графика. В пяти полиэтиленовых стаканчиках готовят пробы. В каждый наливают по 10 см3 буферного раствора и 20 см3 0,1, 0,01, 0,001, 0,0001, 0,00001 М растворов NaF соответственно в 1, 2, 3, 4, 5-й стаканчики. Поочередно измеряют ЭДС в каждом полученном растворе (стаканчике). Порядок измерений на иономере должен соответствовать марке прибора (см. приложение 3).
Измерения следует производить не сразу, а через 5 мин после погружения электродов при работающей магнитной мешалке. Результаты заносят в табл. 2.2 и строят график (рис. 2.5).
Таблица 2.2
Построение градуировочной зависимости Е – рF
(концентрация стандартного раствора – 0,1 моль/дм3)
Концентрация рабочего раствора, моль/дм3 |
Объем рабочего раствора, см3 |
[F–], моль/дм3 |
pF = – lg[F–] |
Е, мВ |
… |
… |
… |
… |
… |
Учебная задача. Готовят раствор любой концентрации, но так, чтобы она была в пределах градуировочного графика. Измеряют ЭДС раствора и по графику проверяют, соответствует ли ЭДС заданной концентрации. Если относительное отклонение между заданной и измеренной концентрацией лежит в пределах 5%, приступают к контрольной задаче.
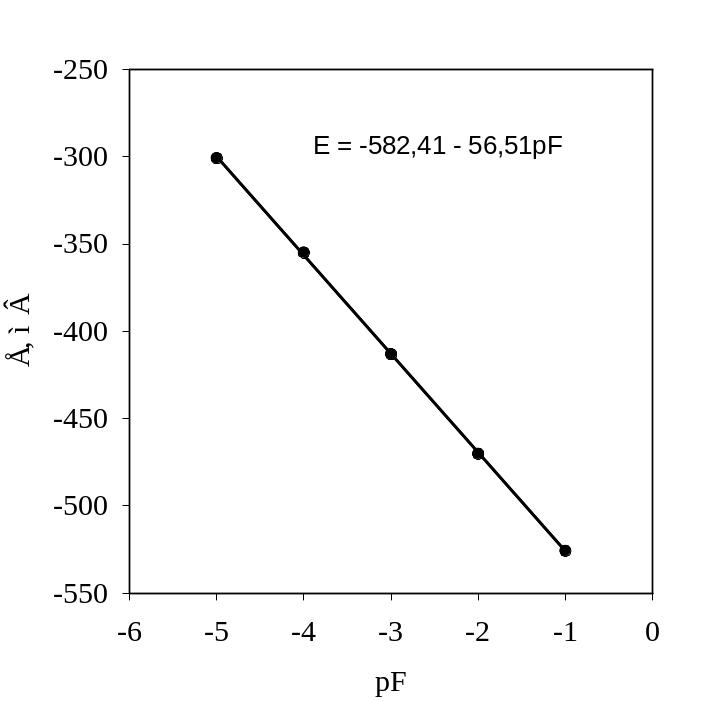
Рис. 2.5. Градуировочная кривая – зависимость потенциала
фторид-селективного электрода от pF = –lg CF-
Контрольная задача. Получают определенный объем исследуемого раствора у инженера лаборатории. Измеряют ЭДС ячейки в этом растворе.
Задание
1. По результатам построения градуировочного графика рассчитыва-ют коэффициенты градуировочной функции (см. приложение 1), пользуясь методом наименьших квадратов (например, с помощью Microsoft Excel). Рассчитывают остаточное и стандартное отклонения, доверительный интервал для измеренной величины концентрации (см. приложение 1).
2. По градуировочному графику определяют концентрацию раствора в задаче (моль/дм3 и г/дм3).
3. При наличии измерений в серии параллельных опытов проводят статистическую обработку результатов анализа: рассчитывают среднее арифметическое значение, среднеквадратичную ошибку, доверительный интервал, относительную ошибку определения (см. приложение 2).
Контрольные вопросы
1. Мембранные электроды. Их разновидности.
2. Что такое мембранный потенциал?
3. Ион-селективные электроды, их устройство и механизм действия.
4. Свойства используемых полупроницаемых мембран.
5. Катионитовые и анионитовые мембраны.
6. Процессы, происходящие на границе раздела «мембрана – раствор».
7. Порядок хранения и использования мембранных электродов.
8. Электроды с твердыми мембранами (гомогенными, гетерогенными).
9. Устройство стеклянного электрода. Характер зависимости для него «потенциал – рН».
