
- •Синтезы неорганических веществ
- •Минск 2009 Введение
- •1. Основные требования техники безопасности и правила работы
- •1.1. Общие принципы и рекомендации
- •1.2. Некоторые правила работы с веществами
- •2. Оборудование и основные операции, используемые для проведения синтеза и разделения веществ
- •2.1. Общие замечания
- •2.2. Глоссарий химической посуды и оборудования
- •2.2.1. Посуда для измерения объемов
- •2.2.2. Посуда и оборудование для подготовки веществ к синтезу и проведения химических реакций
- •2.2.3. Посуда для выделения и очистки веществ
- •2.3. Некоторые методы и приемы работы
- •2.3.1. Промывка осадка методом декантации
- •2.3.2. Центрифугирование
- •2.3.3. Перекристаллизация
- •Пример 1. Очистка нитрата калия
- •Пример 2. Очистка гидрокарбоната натрия с осаждением органическим растворителем
- •3. Методики синтезов
- •3.1. Водород и его соединения Водород н2
- •Исследование свойств полученного вещества.
- •Вопросы для допуска
- •Вопросы и задания для обсуждения
- •3.2. Соединения р-элементов VII группы
- •Исследование свойств полученного вещества.
- •Вопросы для допуска.
- •Вопросы и задания для обсуждения
- •Хлороводородная кислота hCl
- •Исследование свойств полученного вещества
- •Вопросы для допуска
- •Вопросы для обсуждения
- •3.3. Соединения р-элементов VI группы Кислород о2.
- •Исследование свойств полученного соединения
- •Вопросы для допуска
- •Вопросы и задания для обсуждения
- •Октагидрат пероксида бария BaO2·8h2o
- •Исследование свойств полученного вещества.
- •Вопросы и задания для допуска
- •Вопросы и задания для обсуждения
- •Пентагидрат тиосульфата натрия Na2s2o35h2o
- •Исследование свойств полученного вещества
- •Вопросы для допуска
- •Вопросы и задания для обсуждения
- •Гептагидрат сульфата железа (II) FeSo4·7h2o
- •Исследование свойств полученного вещества
- •Вопросы для допуска
- •Вопросы и задания для обсуждения
- •Гептагидрат сульфата кобальта (II) СoSo47h2o
- •Вопросы для допуска
- •Вопросы и задания для обсуждения
- •Гептагидрат сульфата никеля (II) NiSo4·7h2o
- •Исследование свойств полученного вещества
- •Вопросы и задания для допуска
- •Вопросы и задания для обсуждения
- •3.4. Соединения р-элементов V группы Цинкаммонийфосфат nh4ZnPo4
- •Исследование свойств полученного вещества.
- •Вопросы для допуска
- •Вопросы и задания для обсуждения
- •Гексагидрат нитрата железа (II) Fe(no3)26h2o
- •Исследование свойств полученного вещества.
- •Вопросы для допуска
- •Вопросы и задания для обсуждения
- •Дигидрофосфат аммония nh4h2po4
- •Исследование свойств полученного вещества.
- •Вопросы для допуска
- •Вопросы и задания для обсуждения
- •3.5. Соединения р-элементов IV группы Карбонат гидроксомеди (II) (CuOh)2со3
- •Исследование свойств полученного вещества.
- •Вопросы для допуска
- •Вопросы и задания для обсуждения
- •Карбонат кобальта (II) CoCo3
- •Исследование свойств полученного вещества.
- •Вопросы для допуска
- •Вопросы и задания для обсуждения
- •Карбонаты цинка и марганца (II) ZnCo3, MnCo3
- •Вопросы для допуска
- •Вопросы и задания для обсуждения
- •Кремний Si
- •Вопросы для допуска
- •Вопросы и задания для обсуждения
- •Оксид олова (іv) SnO2
- •Исследование свойств полученного вещества.
- •Вопросы для допуска
- •Вопросы и задания для обсуждения
- •3.6. Соединения р-элементов III группы Борная кислота н3во3
- •Исследование свойств полученного вещества.
- •Вопросы для допуска
- •Вопросы и задания для обсуждения.
- •Декагидрат тетрабората натрия (бура) Na2b4о710н2о
- •Вопросы для допуска
- •Вопросы и задания для обсуждения.
- •Тетрагидрат пероксобората натрия NaBo34h2o
- •Исследование свойств полученного вещества.
- •Вопросы для допуска
- •Вопросы и задания для обсуждения
- •Додекагидрат сульфата калия-алюминия (аммония-алюминия), алюмокалиевые (алюмоаммонийные) квасцы kAl(so4)212h2o (nh4Al(so4)212h2o)
- •Исследование свойств полученного вещества.
- •Вопросы для допуска.
- •Вопросы и задания для обсуждения
- •3.7. Соединения s-элементов II и I групп Гидроксид натрия
- •Вопросы для допуска
- •Вопросы и задания для обсуждения
- •Сульфат кальция CaSo4
- •Вопросы для допуска
- •Вопросы и задания для обсуждения
- •Декагидрат сульфата натрия Na2so410h2o
- •Вопросы для допуска
- •Вопросы и задания для обсуждения
- •3.8. Соединения d-элементов Гидроксид никеля (II) Ni(oh)2
- •Исследование свойств полученного вещества.
- •Вопросы и задания для допуска
- •Вопросы и задания для обсуждения
- •Соль Мора (nh4)2Fe(so4)26h2o
- •Исследование свойств полученного вещества
- •Вопросы для допуска
- •Вопросы и задания для обсуждения
- •Додекагидрат сульфата калия-хрома (III) (хромокалиевые квасцы) kCr(so4)2·12h2o
- •Исследование свойств полученного вещества.
- •Вопросы и задания для допуска
- •Вопросы и задания для обсуждения
- •Тригидрат трис-оксалатохромита калия k3[Cr(c2o4)3]·3h2o
- •Исследование свойств полученного вещества
- •Вопросы для допуска
- •Вопросы и задания для обсуждения
- •Оксид меди (I) Cu2o
- •Вопросы и задания для обсуждения.
- •Моногидрат ацетата меди (II) Cu(ch3coo)2·h2o
- •Вопросы для допуска
- •Вопросы и задания для обсуждения
- •Оксид хрома (III) Cr2o3
- •Вопросы для допуска
- •Вопросы и задания для обсуждения
- •Хромат калия k2CrO4
- •Исследование полученного вещества
- •Вопросы для допуска
- •Вопросы и задания для обсуждения.
- •Оксалат марганца (II) MnC2o4
- •Вопросы для допуска
- •Вопросы и задания для обсуждения
- •Тетрахлорцинкат аммония (nh4)2[ZnCl4]
- •Исследование свойств полученного вещества
- •Вопросы для допуска
- •Вопросы и задания для обсуждения
- •Дигидрат ацетата цинка Zn(ch3coo)2·2h2o
- •Исследование свойств полученного вещества
- •Вопросы для допуска
- •Вопросы и задания для обсуждения
- •Хлорид гексаамминкобальта (III) [Co(nh3)6]Cl3
- •Вопросы для допуска
- •Вопросы и задания для обсуждения
- •Хлорид гексаамминникеля (II) [Ni(nh3)6]Cl2
- •Вопросы для допуска
- •Вопросы и задания для обсуждения
- •Моногидрат сульфата тетраамминмеди (II) [Cu(nh3)4]so4н2о
- •Исследование свойств полученного вещества.
- •Вопросы для допуска
- •Вопросы и задания для обсуждения
- •Литература
- •Содержание
- •Приложение. Образец протокола с указаниями по его заполнению
- •Учебное издание
Вопросы для допуска.
(1) Почему для синтеза используется сухой тигель?
(2) Какая посуда требуется для растирания соли? С какой целью проводится измельчение?
(3) Какое вещество в данной реакции является окислителем?
(4) Для чего это нужно?
(5) Почему йод требуется хранить в бюксе (сосуде с плотно притертой крышкой)? Зачем бюкс предварительно взвешивают?
(6) Какой реактив используется для обнаружения йода?
(7) Сравните растворимость йода в воде и в органических растворителях и объясните различие.
(8) Объясните изменение растворимости йода в присутствии иодида калия.
(9) Объясните, что произошло. Напишите уравнение реакции окисления йода хлорной водой, уравняйте ионно-электронным методом.
Вопросы и задания для обсуждения
Чем объясняется способность иода переходить из твердого состояния непосредственно в газообразное?
Напишите уравнения реакций взаимодействия галогенов с водой и с растворами щелочей на холоде и при нагревании.
Объясните изменение агрегатного состояния простых веществ, образованных элементами-галогенами.
Каким образом получают йод в промышленности. Запишите уравнения соответствующих реакций.
Назовите основные сферы применения хлора, брома, йода.
Какова биологическая роль йода?
Сравните окислительные свойства галогенов. Ответ подтвердите примерами соответствующих реакций.
Сравните восстановительные свойства галогенид-ионов. Ответ сопроводите примерами химических реакций.
В водном растворе происходит реакция I2 + H2S = 2HI + S; H298 = 73,3 кДж. В газовом состоянии веществ реакция протекает в противоположном направлении: 2HI + S = I2 + H2S; H298 = 20,9 кДж. Как объяснить это явление?
Вычислите константы равновесия при 25С процессов I2(к) + I(р) = I3(р) I2(р) + I(р) = I3(р) используя следующие данные: растворимость кристаллического иода в чистой воде составляет 0,0013 моль/дм3, в 0,10 М растворе нитрата натрия – 0,0013 моль/дм3, в 0,10 М растворе иодида калия – 0,0514 моль/дм3.
Хлороводородная кислота hCl
Меры предосторожности: какую опасность для человека представляют концентрированная серная кислота? хлороводород? Какие меры нужно предпринимать при попадании на кожу серной кислоты? При вдыхании хлороводорода?
Методика синтеза. Синтез рассчитан на использование 15¸20 г поваренной соли.
Вычисляют объем концентрированной серной кислоты (w(H2SO4) = 98%, r ≈ 1,835 г/см3) (1), необходимый для проведения реакции с учетом того, что при слабом нагревании реакционной смеси образуется преимущественно кислая соль, а кислоту требуется взять с 30%-м избытком по отношению к количеству, рассчитанному по уравнению реакции.
Синтез проводят в приборе, изображенном на рис. 3.2. Для этого в колбу 1, закрепленную на штативе, помещают заданную массу хлорида натрия (поваренной соли), концентрированную серную кислоту вливают в капельную воронку 2 (при этом проследите за тем, чтобы кран был закрыт), подсоединяют предохранительную склянку 12 (2) и стакан 10 (вместимостью 400 см3) с 50 см3 дистиллированной воды. Необходимо следить, чтобы воронка 9 была погружена в жидкость на глубину 0,5 см (3). Стакан с водой охлаждают в смеси льда и воды (4).
Из капельной воронки по каплям (5) приливают серную кислоту к поваренной соли. Если реакция взаимодействия соли и кислоты замедляется, колбу с реакционной смесью можно слегка подогреть.
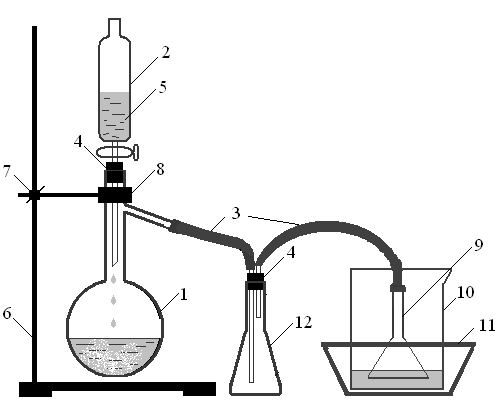
Рис. 3.2. Прибор для получения хлороводорода.
1 – колба Вюрца, 2 – капельная воронка, 3 – соединительные трубки, 4 – резиновые пробки, 5 – серная кислота, 6 – штатив, 7 – муфта, 8 – лапка, 9 – воронка, 10 – стакан с водой, 11 – кристаллизатор со смесью льда и воды, 12 – предохранительная колба или склянка.
По окончании реакции измеряют объем (6) полученного раствора и его плотность (7) и по справочнику определяют массовую долю HCl или его молярную концентрацию. Если содержание HCl в полученном растворе составляет более 0,3 моль/дм3, часть раствора следует разбавить до достижения концентрации 0,1¸0,3 М (8, 9) и протитровать разбавленный раствор 0,1М раствором гидроксида натрия (10). Основываясь на результатах титрования, вычисляют массу хлороводорода, полученную в ходе синтеза и выход хлороводорода (%).
