
- •Вопрос 1
- •Вопрос 2
- •Вопрос 3
- •Вопрос 4
- •Вопрос 5
- •Вопрос 6
- •Вопрос 7
- •Вопрос 8
- •Вопрос 9
- •Вопрос 10
- •Вопрос 11
- •Вопрос 13.
- •Вопрос 14
- •Вопрос 15
- •Вопрос 16
- •Вопрос 17
- •Вопрос 18
- •Вопрос 19
- •Вопрос 20
- •Вопрос 21
- •Вопрос 22
- •Вопрос 23
- •Вопрос 24
- •Вопрос 25
- •Вопрос 26
- •Вопрос 27
- •Вопрос 28
- •Вопрос 29
- •Вопрос 30 Защитные покрытия обеспечивают изоляцию металла от внешней среды и таким образом препятствуют протеканию коррозии. Покрытия делятся на металлические и неметаллические.
Вопрос 10
Квантовые числа — энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится.
Главное квaнтовое число n определяет общую энергию электрона и степень его удаления от ядра (номер энергетического уровня); оно принимает любые целочисленные значения, начиная с 1 (n = 1, 2, 3, . . .)
Орбитальное (побочное или азимутальное) квантовое число l определяет форму атомной орбитали. Оно может принимать целочисленные значения от 0 до n-1(l = 0, 1, 2, 3,..., n-1). Каждому значению l соответствует орбиталь особой формы. Орбитали с l = 0 называются s-орбиталями, l = 1 – р-орбиталями (3 типа, отличающихся магнитным квантовым числом m), l = 2 – d-орбиталями (5 типов), l = 3 – f-орбиталями (7 типов).
Магнитное квантовое число m определяет ориентацию орбитали в пространстве относительно внешнего магнитного или электрического поля. Его значения изменяются от +l до -l, включая 0. Например, при l = 1 число m принимает 3 значения: +1, 0, -1, поэтому существуют 3 типа р-АО: рx, рy, рz.
Спиновое квантовое число s может принимать лишь два возможных значения +1/2 и -1/2. Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона, называемого спином (от англ. веретено). Для обозначения электронов с различными спинами используются символы:
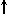 и
и  .
.
Вопрос 11
Электроны распределяются согласно принципу наименьшей энергии: электроны располагаются в такой последовательности, что при данном количестве электронов атом обладает наименьшей энергией.
Правило Кличковского. Из двух квантовых состояний наименьшей энергией обладает то состояние, где сумма квантовых чисел n и l наименьшая. А если сумма одинаковая, то сначала идет состояние с наименьшим n.
Правило Паули В атоме не может быть двух электронов, у которых совпадают все 4 квантовые числа.
2n2-число электронов на уровне. 2(2 *l+1) – число электронов на подуровне.
Правило Хунда В пределах подуровня электроны располагаются по квантовым ячейкам так, чтобы их спины были максимальны.
Вопрос 12Эне́ргией сродства́ а́тома к электро́ну, или просто его сродством к электрону (ε), называют энергию, выделяющуюся в процессе присоединения электрона к свободному атому Э в его основном состоянии с превращением его в отрицательный ион Э− (сродство атома к электрону численно равно, но противоположно по знаку энергии ионизации соответствующего изолированного однозарядного аниона).
Э + e− = Э− + ε
Сродство к электрону выражают в килоджоулях на моль (кДж/моль) или в электронвольтах на атом (эВ/атом).
Электроотрицательность (χ) — фундаментальное химическое свойство атома, количественная характеристика способности атома в молекуле смещать к себе общие электронные пары.
Радиус ядра уменьшается слева направо в периоде, так как число электронов на внешнем энергетическом уровне растёт, а большее число электронов притягивается ядром сильнее, и как следствие, плотнее. Радиус ядра в пределах грууппы сверху вниз растёт, так как увеличивается число электронных уровней и они занимают больше места Таким образом, электроотрицательность в пределах периода РАСТЁТ слева направо, в пределах группы ПАДАЕТ сверху вниз. Самый электроотрицательный элемент - фтор (об электроотрицательности расположенного правее от него неона, или правее и выше гелия говорить не приходится, так как эти элементы не образуют химических соединений и перетягивание ими обобществленных электронных орбиталей не поддаётся измерению, ибо последние не встречаются в природе). Наименее электроотрицательный - франций ( если исключить радиоавтивные - цезий)
