
2. Расчет материального баланса
Дня расчета материального баланса должны быть заданы исходные данные:
В1 - производительность либо по массе сжигаемого колчедана в т/год, либо по массе продукта из рекуперационной серы (серной кислоты какой-либо заданной концентрации или олеума), т/год,
α - массовая доля использования серы, %;
С![]() колч.
- массовая доля влаги в колчедане, %;
колч.
- массовая доля влаги в колчедане, %;
Сsсух.колч. - массовая доля серы в сжигаемом колчедане на сухую массу, %;
Сsогар. - массовая доля серы в огарке, %;
C![]() -
массовая доля SO3
в сухом обжигаемом газе, %;
-
массовая доля SO3
в сухом обжигаемом газе, %;
tвозд. - температура воздуха, подаваемого на сжигание, °С;
tколч. - температура колчедана, подаваемого на сжигание, °С;
φ - относительная влажность воздуха, об.д., %;
tоб.газ.- температура обжигового газа на выходе из печи, °С;
tогар. - температура огарка на выходе из печи, °С.
Сера в колчедане содержится в виде пирита. Уравнение для процессов горения FeS2 до SО2 и суммарное уравнение превращения FeS2 в SO3:
4FeS2 + 11О2 = 2Fe2O3 + 8SO2 (2.1)
4∙120 11·32 2·160 8·64
4FeS2 + 15O2 = 2Fe2O3 + 8SO3 (2.2)
4·120 15·32 2·160 8·80
Вначале рассчитывается масса серы Gsпрод. в серной кислоте или олеуме
а) в разбавленной серной кислоте:
Gsпрод.
=
![]() ;
(2.3)
;
(2.3)
б) в олеуме
Gsпрод.
=
![]() ;
(2.4)
;
(2.4)
где
![]() - массовая доля серной кислоты, %;
- массовая доля серной кислоты, %;
![]() - массовая доля
SO3
в олеуме, %;
- массовая доля
SO3
в олеуме, %;
32 - относительная атомная масса серы;
98 - относительная молекулярная масса серной кислоты;
80 - относительная молекулярная масса SO3.
Масса серы в перерабатываемом колчедане определяется с учетом степени, использования серы:
Gsколч.
=
![]() ;
(2.5)
;
(2.5)
Далее рассчитывается расход колчедана:
В1
=
 ;
(2.6)
;
(2.6)
На эту массу колчедана и производится расчет отдельных статей материального баланса; результаты сводятся в табл. 2.1.
Зачастую не весь пирит успевает сгореть в печи обжига, часть его переходит в огарок. Обычно количество несгоревшего пирита, бывает задано содержанием серы в огарке Csoгap. и для того, чтобы рассчитать массу сгоревшего пирита следует составить уравнение материального баланса по сере:
Gsколч.
= Gогар.
+ G![]() +
G
+
G![]() ;
(2.7)
;
(2.7)
где Gsколч.
; Gогар.
; G![]() ; G
- масса серы в колчедане, огарке, SО2
и SO3
соответственно.
; G
- масса серы в колчедане, огарке, SО2
и SO3
соответственно.
Массовый расход серы в колчедане Gsколч. определяется по уравнениям (2.3); (2.4) и (2.5).
Массовый расход серы в огарке определяется по уравнению:
Gs![]() =
=
![]() ;
(2.8)
;
(2.8)
Огарок состоит из
инертных примесей, поступающих с исходным
колчеданом (Gприм.колч.),
оксида железа (G![]() огар.)
, получившегося при горении пирита, и
несгоревшего пирита (G
огар.)
, получившегося при горении пирита, и
несгоревшего пирита (G![]() огар.).
Масса огарка состоит:
огар.).
Масса огарка состоит:
Gогар.
= Gприм.колч.
+ G![]() огар.
+ G
огар.
+ G![]() огар.
;
(2.9)
огар.
;
(2.9)
Масса инертных примесей рассчитывается по уравнению:
Gприм.колч. = Gсух.мас.колч. - G колч.; (2.10)
где: Gприм.колч - массовый расход инертных примесей в колчедане, кг/ч;
Gсух.мас.колч.- массовый расход сухого колчедана, кг/ч;
G колч. - массовый расход пирита в колчедане, кг/ч.
Массовый расход
Gсух.мас.колч
и G![]() колч.
рассчитываются исходя из величины
массы серы в колчедане по формулам:
колч.
рассчитываются исходя из величины
массы серы в колчедане по формулам:
G![]() =
=
 ;
(2.11)
;
(2.11)
G
![]() =
=
![]() ;
(2.12)
;
(2.12)
Массовый расход воды в колчедане определяется из массы сухого колчедана и его влажности:
№ |
Компоненты |
Приход |
Расход |
||||||
Серосодержащие отход |
Воздух |
Огарок |
Газы обжига |
||||||
кг/ч |
мас.д.,% |
кг/ч |
мас.д.,% |
кг/ч |
мас.д.,% |
кг/ч |
мас.д.,% |
||
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
1 |
Пирит (FeS2) |
|
|
|
|
|
|
|
|
2 |
Примеси инертные |
|
|
|
|
|
|
|
|
3 |
Оксид железа (Fe2О3) |
|
|
|
|
|
|
|
|
4 |
Вода, (Н2О) |
|
|
|
|
|
|
|
|
5 |
Азот, (N2) |
|
|
|
|
|
|
|
|
6 |
Кислород, (О2) |
|
|
|
|
|
|
|
|
7 |
Оксид серы (ӀV), (SO2) |
|
|
|
|
|
|
|
|
8 |
Оксид серы (ӀӀӀ), (SO3) |
|
|
|
|
|
|
|
|
9 |
Сумма |
|
100 |
|
100 |
|
100 |
|
100 |
10 |
Итого: |
|
|
|
|
|
|
|
|
![]() =
=
 (2.13)
(2.13)
Рассчитанные
массовые расходы G
колч.
, Gприм.колч.
и G![]() колч.
вносятся
в табл. 2.1 материального баланса (графа,
строки 1,2 и 4), подсчитывается сумма (стр.
7) и мас.д., % компонентов колчедана (графа
4, строки 1,2 и 4).
колч.
вносятся
в табл. 2.1 материального баланса (графа,
строки 1,2 и 4), подсчитывается сумма (стр.
7) и мас.д., % компонентов колчедана (графа
4, строки 1,2 и 4).
Массовый расход оксида железа (Fe2Оз) можно рассчитать по уравнениям (2.1) и (2.2), если известна масса сгоревшего пирита. В рассматриваемом случае массу сгоревшего пирита можно представить как разницу между исходной массой пирита в колчедане G и оставшимся пиритом в огарке G огар.:
![]() (2.14)
(2.14)
Тогда массовый расход оксида железа (Fe2Оз) будет равен:
![]() ;
(2.15)
;
(2.15)
Масса огарка рассчитывается по уравнению:
Gогар.
=
Gприм.колч.
+ G
+
G
огар.
=
Gприм.колч.
+
![]() .
(2.16)
.
(2.16)
Масса серы в огарке:
Gsогар.
=
![]() ;
(2.17)
;
(2.17)
Массовый расход серы в SО2 и SO3 равна массе серы в сгоревшем пирите:
![]() =
=
![]() ;
(2.18)
;
(2.18)
Совместив уравнения
(2.5); (2.17) и (2.18) можно получить равенство:
 (2.19)
(2.19)
в котором будет одна неизвестная величина - масса G огар.. После определения из этого равенства масса G огар., по уравнениям (2.14) и (2.15) рассчитывается масса G сгор. и G , величина массы G вносится в табл. 2.1 материального баланса (графа 6, строка 3). В эту же графу 6 переносится из графы 3 величина массы инертных примесей (строка 2) и записывается масса несгоревшего пирита S2 G огар. в строку 1.
Затем подсчитывается суммарная величина массы огарка (строка 9) и массовая доля всех компонентов огарка в процентном выражении.
При горении пирита (уравнения (2.1) и (2.2)) образуются оксиды серы, количество молей которых в 2 раза больше количества молей сгоревшего пирита:
![]() =
=![]()
![]() .
(2.20)
.
(2.20)
Количество молей
![]() и
и
![]() :
:
=
![]() ;
(2.21)
;
(2.21)
![]() =
=
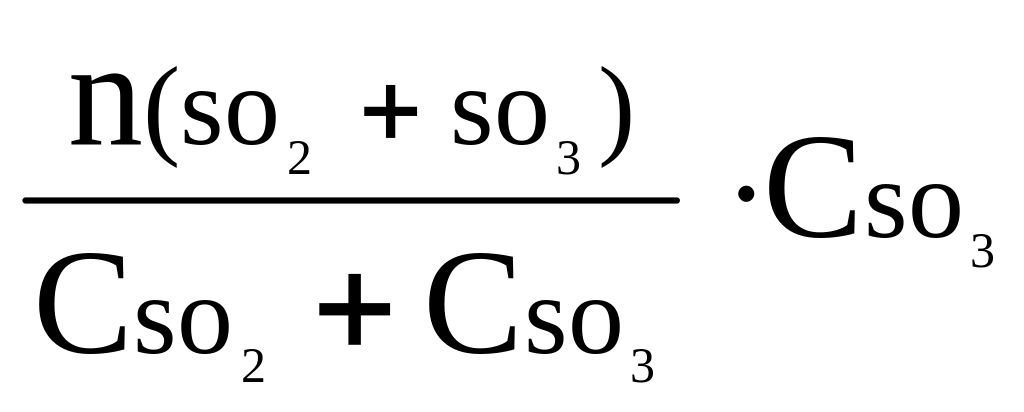 .
(2.22)
.
(2.22)
Массы SO2 и SO3 рассчитываются умножением количеств молей этих компонентов на их молекулярные массы:
![]() ;
(2.23)
;
(2.23)
![]() ;
(2.24)
;
(2.24)
и вносятся в графу 8 таблицы материального баланса (строки 7 к 8).
Обжиговый газ
состоит из SО2;
SO3;
N2;
O2
и паров воды. Количество молей обжигового
газа
![]() :
:
![]() =
=
 (2.25)
(2.25)
Количество молей
азота
![]() :
:
=
![]() · 0,79
, (2.26)
· 0,79
, (2.26)
где
![]() сух.возд.
- количество молей сухого воздуха,
поступившего в печь обжига (оно будет
рассчитываться в дальнейшем).
сух.возд.
- количество молей сухого воздуха,
поступившего в печь обжига (оно будет
рассчитываться в дальнейшем).
Количество молей кислорода в воздухе:
![]() =
· 0,21. (2.27)
=
· 0,21. (2.27)
Количество молей кислорода в обжиговом газе:
![]() =
= ; (2.28)
; (2.28)
Количество молей
паров воды
![]() будет равно сумме количества молей
воды, поступившего с колчеданом
будет равно сумме количества молей
воды, поступившего с колчеданом
![]() количества молей воды, поступившего с
воздухом
количества молей воды, поступившего с
воздухом
![]() возд.:
возд.:
![]() =
=
![]() +
;
(2.29)
+
;
(2.29)
=
![]() ;
(2.30)
;
(2.30)
![]() возд.
=
возд.
=

![]() ;
(2.31)
;
(2.31)
где C возд. – объемная доля водяных паров в воздухе.
![]() =
=![]() ;
(2.32)
;
(2.32)
где Робощ.- давление насьпценных паров в воздухе, Па (выбирается из табл.3 прилож. в зависимости от температуры воздуха);
![]() - относительная
влажность воздуха, об.д.;
- относительная
влажность воздуха, об.д.;
Робж. - давление в печи обжига, обычно принимается равным, 105 Па
обж.газ.
=
![]() (2.33)
(2.33)
Объединением уравнений (2.25 - 2.33) получается равенство:
 (2.34)
(2.34)
из которого можно
определить nсух.возд.
.Далее по
уравнению (2.26) определяется количество
молей азота
![]() и их масса:
и их масса:
![]() =
=
![]() · 28;
(2.35)
· 28;
(2.35)
По уравнению (2.27)
определяется количество молей кислорода
в воздухе
![]() сух.возд.
а
затем рассчитывается его масса по
уравнению:
сух.возд.
а
затем рассчитывается его масса по
уравнению:
![]() (2.36)
(2.36)
По уравнениям (2.31) и (2.32) определяется количество молей воды в воздухе сух.возд., а затем её масса:
![]() ;
(2.37)
;
(2.37)
Результаты расчетов по формулам (2.36), (2.37) и (2.38) вносятся в графу 5 табл. 2.1 материального баланса (строки 4, 5 и 6), подсчитывается сумма (строка 9) и рассчитывается массовая доля компонентов.
Масса азота
![]() переносится в графу 8 табл. 2.1 материального
баланса (строка 5). Расчет числа молей
кислорода в обжиговом газе проводится
по уравнениям (3.28) и (3.29), а затем
определяется их масса по уравнению:
переносится в графу 8 табл. 2.1 материального
баланса (строка 5). Расчет числа молей
кислорода в обжиговом газе проводится
по уравнениям (3.28) и (3.29), а затем
определяется их масса по уравнению:
![]() обж.газ.
=
обж.газ.
· 32; (2.38)
обж.газ.
=
обж.газ.
· 32; (2.38)
Масса воды в обжиговом газе определяется как сумма её масс, поступающей на горение с колчеданом и воздухом:
![]() обж.газ.
=
колч.
+
возд.
(2.39)
обж.газ.
=
колч.
+
возд.
(2.39)
Массы недостающих компонентов обжигового газа (азота, кислорода и воды) вносятся в графу 8 табл. 2.1 материального баланса (строки 4, 5 и 6), подсчитывается сумма по графе 8 (строка 9) и содержания компонентов в обжиговом газе (графа 9).
В заключение расчета материального баланса определяются итоговые суммы по приходной и расходной статьям (строка 10) и погрешность баланса, %:
b
=
![]() , (2.40)
, (2.40)
Если погрешность баланса превышает 0,5 %, то расчет повторяется с большей точностью.
ПРИЛОЖЕНИЕ
Таблица 1
Теплоемкость Ср, кДж/(н·м3·град)
Температура, ̊С |
SO2 |
N2 |
O2 |
Воздух сухой |
Водяные пары |
0 |
1,779 |
1,304 |
1,313 |
1,302 |
1,495 |
100 |
1,937 |
1,306 |
1,337 |
1,309 |
,1,506 |
200 |
2,084 |
1,318 |
1,379 |
1,327 |
1,521 |
250 |
2,147 |
1,326 |
1,406 |
1,339 |
1,535 |
300 |
2,207 |
1,340 |
1,424 |
1,353 |
1,544 |
350 |
2,252 |
1,353 |
1,446 |
1,368 |
1,555 |
400 |
2,293 |
1,367 |
1,465 |
1,384 |
1,567 |
450 |
2,330 |
1,382 |
1,483 |
1,400 |
1,578 |
500 |
2,366 |
1,397 |
1,500 |
1,413 |
1,591 |
550 |
2,393 |
1,412 |
1,517 |
1,430 |
1,603 |
600 |
2,415 |
1,425 |
1,531 |
1,443 |
1,616 |
650 |
2,437 |
1,441 |
1,542 |
1,458 |
1,629 |
700 |
2,452 |
1,454 |
1,554 |
1,472 |
1,643 |
750 |
2,474 |
1,476 |
1,564 |
1,484 |
1,655 |
800 |
2,489 |
1,480 |
1,575 |
1,497 |
1,669 |
850 |
2,502 |
1,492 |
1,583 |
1,509 |
1,684 |
900 |
2,513 |
1,502 |
1,592 |
1,521 |
1,700 |
Таблица 2
Теплота парообразования r н2о
Давление Р·10-5, Па |
r, кДж/кг |
0,1 |
2395,0 |
0,2 |
2360,0 |
0,3 |
2338,0 |
0,4 |
2321,0 |
0,5 |
2307,4 |
0,6 |
2296,1 |
0,7 |
2286,1 |
0,8 |
2276,8 |
0,9 |
2268,0 |
1,0 |
2260,5 |
3,0 |
2167,5 |
10,0 |
2020,0 |
20,0 |
1896,4 |
40,0 |
1720,4 |
60,0 |
1579,6 |
Таблица 3
Давление насыщенного водяного пара
Температура, ̊С |
Давление Р·10-5, Па |
0 |
0,0060 |
2 |
0,0070 |
4 |
0,0080 |
6 |
0,0090 |
8 |
0,0105 |
10 |
0,0121 |
15 |
0,0168 |
17 |
0,0191 |
20 |
0,0230 |
23 |
0,0278 |
25 |
0,0313 |
27 |
0,0353 |
30 |
0,0418 |
33 |
0,0492 |
36 |
0,0582 |
40 |
0,0722 |
Варианты индивидуального задания
Ва-риант |
В1 , т/ч |
С1, мас. д.,% |
α, мас. д.,% |
Сн2околч., мас. д.,% |
Сsс.колч., мас. д.,% |
Сsогар., мас. д.,% |
Сso2, об.д.,% |
Сso3, об.д.,% |
tвозд., оС |
tколч., оС |
φ, об.д.,% |
tоб.газ., оС |
tогар., оС |
1 |
10 |
75 |
0,90 |
7,5 |
42 |
2,6 |
16 |
0,10 |
20 |
220 |
75 |
850 |
50 |
2 |
20 |
75 |
0,90 |
8,0 |
41 |
2,6 |
16 |
0,10 |
30 |
230 |
75 |
860 |
60 |
3 |
25 |
75 |
0,90 |
8,5 |
39 |
2,6 |
16 |
0,10 |
25 |
225 |
75 |
855 |
55 |
4 |
30 |
75 |
0,91 |
8,0 |
40 |
2,5 |
14 |
0,10 |
25 |
225 |
70 |
860 |
60 |
5 |
10 |
70 |
0,85 |
7,5 |
42 |
2,6 |
16 |
0,15 |
20 |
220 |
75 |
850 |
50 |
6 |
20 |
70 |
0,85 |
8,0 |
41 |
2,6 |
16 |
0,15 |
25 |
225 |
70 |
840 |
40 |
7 |
25 |
70 |
0,85 |
7,5 |
43 |
2,5 |
14 |
0,15 |
30 |
230 |
75 |
865 |
70 |
8 |
30 |
70 |
0,85 |
7,5 |
42 |
2,6 |
15 |
0,15 |
20 |
220 |
50 |
850 |
70 |
9 |
5 |
80 |
0,85 |
7,0 |
41 |
2,2 |
14 |
0,20 |
35 |
235 |
70 |
860 |
60 |
10 |
10 |
70 |
0,85 |
7,5 |
38 |
2,3 |
16 |
0,10 |
20 |
230 |
75 |
860 |
70 |
11 |
15 |
80 |
0,92 |
7,0 |
38 |
2,5 |
15 |
0,10 |
10 |
210 |
60 |
840 |
50 |
12 |
15 |
85 |
0,92 |
7,5 |
37 |
2,5 |
15 |
0,10 |
15 |
215 |
60 |
845 |
60 |
13 |
20 |
80 |
0,90 |
7,2 |
40 |
2,4 |
16 |
0,20 |
15 |
220 |
70 |
850 |
50 |
14 |
10 |
70 |
0,85 |
7,5 |
41 |
2,3 |
16 |
0,20 |
20 |
230 |
75 |
855 |
50 |
Учебное издание
