
- •Метаболизм белков Особая роль белков в питании
- •Переваривание и всасывание белков в желудочно-kишечном тракте
- •Механизмы, защищающие белки от действия протеиназ:
- •Ингибиторы сериновых протеиназ.
- •Ингибиторы тиоловых протеиназ
- •Катаболизм аминокислот.
- •3. Гистидиндекарбоксилаза
- •Строение и свойства белков.
- •Основные различия в строении белковых молекул
- •II. Биологическая классификация.
- •Типы связей между аминокислотами в молекуле белка
- •Слабые типы связей
- •Пространственная организация белковой молекулы
- •Первичная структура
- •Вторичная структура
- •Третичная структура
- •Четвертичная структура
- •Методы определения первичной структуры белка
- •1)Деградация по Эдмону
- •2) Секвенирование днк
- •3) Рентгеноструктурный анализ
- •Электронная микроскопия
- •Конфигурация и конформация белковой молекулы
- •Лиганды
- •Нативность белковой молекулы
- •Денатурация белка
- •Факторы, вызывающие денатурацию белков
- •Физические факторы
- •Химические факторы
- •Обратимость денатурации
- •Белки стресса
- •Физико-химические свойства белков. Растворимость белков в воде.
- •Факторы стабилизации белка в растворе.
- •Свойства воды гидратной оболочки
- •Способы осаждения белков
- •Осаждение нативных белков
- •Осаждение денатурированных белков
- •Обмен сложных белков обмен нуклеопротеинов
- •Обмен нуклеиновых кислот
- •Различия в катаболизме пуриновых и пиримидиновых азотистых оснований.
- •Функции мочевой кислоты:
- •Синтез мононуклеотидов
- •Синтез пиримидиновых мононуклеотидов.
- •Синтез нуклеиновых кислот из мононуклеотидов
- •Строение и свойства ферментов
- •Общие свойства катализаторов
- •Особенности ферментов как биологических катализаторов
- •Строение ферментов
- •I класс - оксидоредуктазы.
- •Кинетика ферментативного катализа
- •Характеристика конкурентных ингибиторов
- •Автономная саморегуляция ферментативных процессов
- •2. Субстрат - аллостерический активатор своего фермента.
- •3. Продукт реакции - аллостерический активатор своего фермента.
- •4. Один субстрат - два фермента и два продукта.
- •5. Один субстрат, два фермента и один продукт
- •Биологическое окисление. Понятие о метаболизме.
- •История развития учения о биоокислении.
- •Современная теория биоокисления
- •Митохондриальное окисление (МтО).
- •Главная (полная) цепь
- •Укороченная (сокращенная) цепь
- •Главная дыхательная цепь
- •Митохондриального окисления
- •Синтез атф.
- •Никотинамидные дегидрогеназы (надг)
- •Комплекс I
- •Комплекс III.
- •Комплекс IV.
- •Основные процессы, для которых используется энергия атф:
- •Синтез атф.
- •Специфические ингибиторы тканевого дыхания
- •Вещества-разобщители процессов окисления и фосфорилирования
- •Теория сопряжения окисления и фосфорилирования питера митчелла.
- •Автономная саморегуляция системы митохондриального окисления
- •Варианты дыхательной цепи.
- •1. Полная дыхательная цепь
- •2. Сокращенная (укороченная) дыхательная цепь
- •3. Максимально сокращенная (максимально укороченная) дыхательная цепь.
- •Окислительное декарбоксилирование пировиноградной
- •Окислительное декарбоксилирование пирувата
- •Цикл трикарбоновых кислот
- •Итоговое уравнение цтк
- •Биологическое значение цтк
- •Автономная саморегуляция цтк
- •Энергетический заряд клетки (эзк)
- •Челночные механизмы переноса водорода
- •Внемитохондриальное окисление
- •I. Окисление оксидазного типа.
- •II. Окисление оксигеназного типа
- •Примеры реакций оксигеназного типа окисления
- •Антиоксидантная система.
- •1. Ферментативная
- •В) пероксидаза.
- •2. Неферментативные компоненты антиоксидантной системы
- •Параметаболизм
- •Некоторые параметаболические процессы
- •Биохимические основы питания человека.
- •Метаболизм углеводов и его регуляция.
- •Переваривание и всасывание углеводов
- •Синтез и распад гликогена.
- •(Гексозобисфосфатный путь распада углеводов)
- •Особенности первого этапа гбф-пути
- •Гликолиз. Гликогенолиз. Гликолитическая оксидоредукция. Обращение гликолиза
- •Судьба лактата, образовавшегося при гликолизе
- •Глюконеогенез
- •Автономная саморегуляция гбф-пути.
- •(Гексозомонофосфатный путь метаболизма глюкозы)
- •I. Окислительный этап.
- •Биологическое значение I этапа гмф-пути:
- •Биологическое значение II этапа гмф-пути:
- •Автономная саморегуляция гмф-пути.
- •Гормональная регуляция метаболизма углеводов гормональная регуляция энергетического метаболизма.
- •Гормоны прямого действия.
- •Гормоны косвенного действия
- •Химия и обмен липидов.
- •Липопротеины
- •Пищевой жир.
- •Липогенез.
- •Гормональная регуляция синтеза жира
- •Катаболизм жира
- •Пути метаболизма глицерина
- •Распад глицерина по пути к углеводам
- •Пути использования жирных кислот.
- •Катаболизм жирных кислот
- •Реакции синтеза кетоновых тел
- •Утилизация кетоновых тел
- •Биохимия фосфолипидов, гликолипидов и стероидов. Биологические мембраны. Биологические мембраны
- •Фосфолипиды.
- •Роль мембранных белков.
- •Роль углеводных компонентов мембран
- •Функции липоидов
- •Катаболизм липоидов.
- •Биохимия крови.
- •Функции крови.
- •Альбумины
- •Функции альбуминов
- •Глобулины
- •Функции 1-глобулинов
- •Биохимия мышечной ткани
- •1. Специальные реакции субстратного фосфорилирования
- •2. Гликолиз, гликогенолиз.
- •3. Окислительное фосфорилирование.
- •Биохимия нервной ткани
- •2) Пептиды
- •Биохимия костной ткани, тканей зуба, биохимия слюны.
- •Органический матрикс кости.
- •Дентин.
- •Пульпа.
- •Биохимия почек.
- •1. Ультрафильтрация
- •2. Реабсорбция
- •3. Секреция
- •1. Водно-солевой гомеостаз.
- •2. Участие почек в регуляции кислотно-щелочного равновесия
- •2) Аммониогенез
- •3) Глюконеогенез
Физико-химические свойства белков. Растворимость белков в воде.
Большинство белков гидрофильны. Однако белковые молекулы имеют очень большие размеры, поэтому белки не могут образовывать истинных растворов, а только коллоидные. Внешнее проявление этого - это эффект Тиндаля (или конус Тиндаля). Эффект Тиндаля вызывается рассеянием тонкого пучка света при прохождении через белковый раствор. Несмотря на большую величину, многие белковые молекулы не осаждаются в водных растворах. Осаждению белковых молекул препятствуют факторы стабилизации белкового раствора.
Факторы стабилизации белка в растворе.
ГИДРАТНАЯ ОБОЛОЧКА - это слой молекул воды, определенным образом ориентированных на поверхности белковой молекулы. Поверхность большинства белковых молекул заряжена отрицательно, и диполи молекул воды притягиваются к ней своими положительно заряженными полюсами (смотрите рисунок).
Ч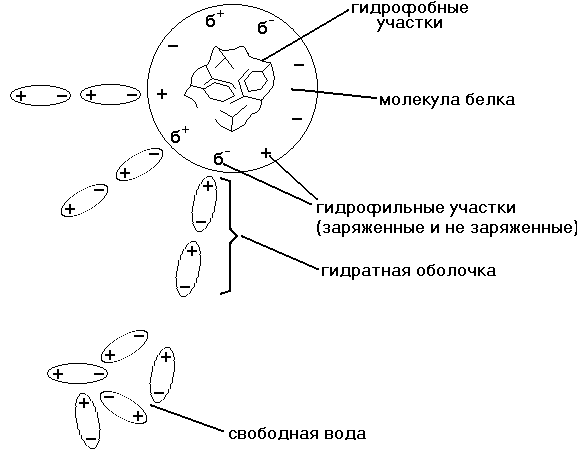 ем
больше гидрофильных свойств у белковой
молекулы, чем больше в ее составе и на
ее поверхности аминокислот с полярными
(гидрофильными) радикалами, тем сильнее
выражена и прочнее удерживается
гидратная оболочка и тем больше в ней
слоев. Вода гидратной оболочки обладает
особыми свойствами: она не является
свободной, а связана с белковой молекулой.
Это - “связанная” вода. Она принадлежит
белку, и поэтому имеет особые свойства.
ем
больше гидрофильных свойств у белковой
молекулы, чем больше в ее составе и на
ее поверхности аминокислот с полярными
(гидрофильными) радикалами, тем сильнее
выражена и прочнее удерживается
гидратная оболочка и тем больше в ней
слоев. Вода гидратной оболочки обладает
особыми свойствами: она не является
свободной, а связана с белковой молекулой.
Это - “связанная” вода. Она принадлежит
белку, и поэтому имеет особые свойства.
Свойства воды гидратной оболочки
а) Температура кипения выше 1000С.
б) Температура замерзания ниже 0ОС.
в) В воде гидратной оболочки не растворяются различные соли и другие гидрофильные вещества.
г) Окружая каждую молекулу белка, гидратная оболочка не дает этим белковым молекулам сблизиться, соединиться и выпасть в осадок.
2) ЗАРЯД БЕЛКОВОЙ МОЛЕКУЛЫ. Поверхность большинства белковых молекул заряжена потому, что в каждой молекуле белка есть свободные заряженные СОО- и NH3+ группы. Изоэлектрическая точка (ИЭТ) большинства белков организма находится в слабокислой среде. Это означает, что у таких белков количество кислотных (СООН) групп больше количества основных групп (NH3). рН плазмы крови около 7,36 - это выше ИЭТ большинства белков, поэтому в плазме крови белки имеют отрицательный заряд.
Способы осаждения белков
Делятся на две группы:
1) Способы осаждения нативного белка
2) Способы осаждения денатурированного белка
Чтобы осадить белок из раствора, надо лишить его обоих факторов стабилизации: и заряда, и гидратной оболочки.
Осаждение нативных белков
Чтобы сохранить нативность белковой молекулы, ее заряд можно устранить только одним способом: приблизить рН среды к изоэлектрической точке белка (ИЭТ), а для большинства белков нашего организма ИЭТ находится в слабокислой среде. Другой фактор стабилизации - гидратную оболочку можно устранить разными способами.
Наиболее типичным примером осаждения нативного белка является ВЫСАЛИВАНИЕ.
а) ВЫСАЛИВАНИЕ - это осаждение белков высокими концентрациями нейтральных солей щелочных и щелочноземельных металлов, поскольку такие соли очень гидрофильны и обладают в высоких концентрациях водоотнимающими свойствами. Чаще это NaCl, Na2SO4, (NH4)2SO4, CaCl2. По мере добавления таких солей к раствору белка они сначала растворяюся в свободной воде, а затем, при дальнейшем повышении концентрации соли, конкурируют с белком за обладание водой, которая входит в состав гидратных оболочек. Белки менее гидрофильные, которые плохо удерживают воду гидратной оболочки, теряют ее раньше. Более гидрофильные белки требуют большей концентрации соли для высаливания. Поэтому с помощью высаливания можно разделить белки с разной степенью гидрофильности. Таким способом, например, можно разделить альбумины и глобулины плазмы крови.
При высаливании сохраняется нативность белковых молекул. Если осадить белки с помощью высаливания, а затем уменьшить концентрацию солей, например, методом диализа, то белок опять растворится.
Осаждения белков без потери ими нативности можно достичь также с помощью водоотнимающих средств.
б) ПРИМЕНЕНИЕ ВОДООТНИМАЮЩИХ СРЕДСТВ. Такими средствами являются растворители, которые смешиваются с водой в любых соотношениях. Чаще всего это ацетон, этиловый спирт. Эти вещества отнимают гидратные оболочки белков, и белки выпадают в осадок, если они лишены заряда. Но, в отличие от высаливания, осадок сразу (немедленно!) должен быть отделен от растворителя. Если растворитель и белок будут длительно находиться в контакте, то могут произойти необратимые изменения структуры белковой молекулы (денатурация).
