
- •Часть 3
- •Растворимость. Способы выражения состава растворов Краткие теоретические сведения
- •Примеры решения задач
- •156, 2 Г раствора — 100,0 г н2о;
- •50,0 Г раствора — m1 г н2о;
- •1 Моль (278 г) FeSo4 ·7h2о содержит 1 моль (152 г) FeSo4 ;
- •50 Г FeSo4 ·7h2о содержит m2 г FeSo4 ;
- •Разбавленные растворы неэлектролитов Краткие теоретические сведения
- •Примеры решения задач
- •Растворы электролитов Краткие теоретические сведения
- •Примеры решения задач
- •Ионное произведение воды. Буферные растворы Краткие теоретические сведения
- •Примеры решения задач
- •Произведение растворимости Краткие теоретические сведения
- •Выражение для произведения растворимости имеет вид
- •Примеры решения задач
- •Гидролиз солей Краткие теоретические сведения
- •Примеры решения задач
- •Список литературы
- •Содержание
Разбавленные растворы неэлектролитов Краткие теоретические сведения
Вещества, которые в растворе не распадаются на ионы, а существуют в виде сольватированных молекул, называются неэлектролитами.
Разбавленные растворы неэлектролитов, относящихся к нелетучим веществам, обладают рядом коллигативных свойств. Коллигативными свойствами растворов называются такие свойства, которые зависят только от количества растворённых частиц, то есть от концентрации. К таким свойствам относятся:
Понижение давления пара (первый закон Рауля).
Относительное понижение давления насыщенного пара растворителя при образовании раствора равно мольной доле растворенного вещества. Или математически
![]() =
=
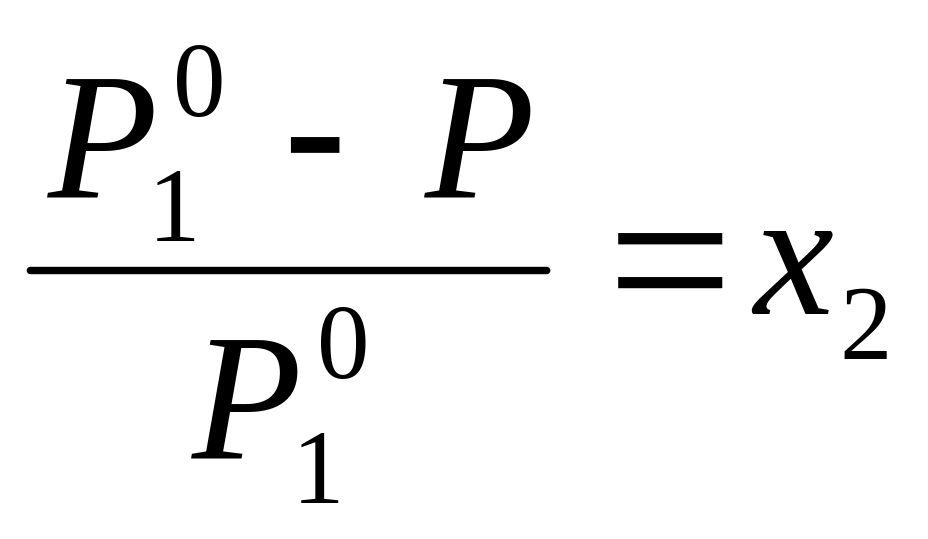 ,
(13)
,
(13)
где Р
– давление
насыщенного пара над раствором; Р![]() – давление
насыщенного пара чистого растворителя;
х2
– мольная доля растворенного вещества.
– давление
насыщенного пара чистого растворителя;
х2
– мольная доля растворенного вещества.
Повышение температуры кипения раствора (второй закон Рауля).
Повышение температуры кипения раствора DTкип прямо пропорционально моляльной концентрации растворенного вещества.
DTкип =
Tкип–
Т ![]() = КЭ ×
Сm,
(14)
= КЭ ×
Сm,
(14)
где КЭ
– эбуллиоскопическая константа,
![]() ;
Сm
- моляльная
концентрация, моль/кг;
Т
-
температура кипения чистого растворителя,
К или С;
Tкип
– температура кипения раствора, К или
С.
;
Сm
- моляльная
концентрация, моль/кг;
Т
-
температура кипения чистого растворителя,
К или С;
Tкип
– температура кипения раствора, К или
С.
Понижение температуры замерзания (кристаллизации) раствора.
Понижение температуры замерзания раствора DTзам прямо пропорционально моляльной концентрации растворенного вещества.
DTзам =
Т ![]() – Tзам =
КК ×
Сm,
(15)
– Tзам =
КК ×
Сm,
(15)
где КК – криоскопическая константа, ; Т - температура замерзания чистого растворителя, К или С; Tзам – температура замерзания раствора, К или С.
Таким образом, раствор кипит при более высокой температуре, чем чистый растворитель, а замерзает при более низкой температуре. Значение эбуллиоскопической и криоскопической константы зависит только от природы растворителя и приведено в справочной литературе.
По повышению температуры кипения или понижению температуры замерзания раствора можно вычислить молярную массу растворенного вещества
M2
= КЭ
![]() .
(16)
.
(16)
M2
= KК
![]() .
(17)
.
(17)
Осмотическое давление (закон Вант-Гоффа).
Давление, которое нужно приложить к раствору, чтобы остановить одностороннюю диффузию растворителя через полупроницаемую перегородку, называют осмотическим (Росм). Закон Вант-Гоффа гласит, что осмотическое давление численно равно тому давлению, которое оказывало бы растворенное вещество, если бы оно при данной температуре находилось в состоянии идеального газа и занимало объем, равный объему раствора
Росм = С2 R T , (18)
где Pосм
– осмотическое давление, кПа; С2
– молярная концентрация вещества,
моль/дм3;
R
= 8,314
![]() – универсальная газовая постоянная;
Т
– абсолютная температура, К.
– универсальная газовая постоянная;
Т
– абсолютная температура, К.
Растворы, обладающие одинаковым осмотическим давлением, называются изотоническими. Раствор, имеющий большее осмотическое давление, является гипертоническим, по отношению к раствору с меньшим значением Росм, который называют гипотоническим.
