
- •Методы исследования свойств и продуктов питания
- •Методы исследования свойств сырья и продуктов питания
- •ВвЕдение
- •1. Измерения и их классификация
- •1.1. Единицы измерения величин
- •1.2. Системы единиц
- •Кратные и дольные единицы по гост 1052-78
- •2. Статистический анализ измерений
- •2.1. Погрешности приближенных величин
- •2.2. Математическая статистика измерений
- •2.2.1. Параметры точности ряда измерений
- •Интегральная функция Лапласа
- •2.2.2. Анализ результатов экспериментов
- •2.3. Нахождение оптимальных параметров, применение методов планирования экспериментов
- •2.3.1. Схема Зайделя–Гаусса
- •2.3.2. Метод Бокса
- •2.3.3. Нахождение оптимальных параметров с помощью эвм
- •2.3.4. Пример оптимизации процесса приготовления пивного сусла
- •Матрица экспериментальных данных
- •2.3.5. Пример оптимизации использования питательной среды при культивировании пекарских дрожжей
- •Матрица экспериментальных данных
- •2.3.6. Аппроксимация экспериментальных данных
- •3. Отбор проб сырья, полуфабрикатов и пищевых продуктов для проведения исследований
- •3.1. Отбор проб сыпучих продуктов
- •3.1.1. Отбор проб из вагонов
- •3.1.2.Отбор проб из автомашин
- •3.1.3. Отбор проб из танкеров и барж
- •Размеры проб
- •3.1.4. Отбор проб от партии затаренных сыпучих продуктов
- •3.2. Отбор проб сыпучих продуктов при хранении
- •3.2.1. Отбор проб из бунтов
- •3.2.2. Отбор проб из силосов элеваторов
- •3.2.3. Отбор проб в производстве
- •4. Приемы подготовки проб к анализу
- •4.1. Подсушивание (высушивание)
- •4.2. Измельчение
- •4.2.1. Ступки
- •4.2.2. Терочные машины
- •4.2.3. Дисковые мельницы
- •4.2.4. Фрезерные измельчители
- •4.2.5. Комбинированные мельницы
- •4.2.6. Измельчители в жидкой среде
- •4.2.7. Выбор типа измельчительных устройств
- •4.3. Извлечение растворимых компонентов из твердых и пластичных материалов
- •4.3.1. Отжим
- •4.3.2. Извлечение растворителями
- •4.3.3. Специальные приемы извлечения растворимых компонентов
- •4.4. Разделение смеси различных веществ на компоненты
- •4.4.1. Простая перегонка
- •4.4.2. Ректификация
- •4.4.3. Молекулярная перегонка
- •4.4.4. Фракционирование кристаллизацией из растворов
- •5. Измерение кислотности и окислительно-восстановительного потенциала
- •5.1. Определение активной кислотности
- •5.2. Электрометрический метод определения рН
- •5.3. Определение рН при помощи рН-метра марки лпу-01
- •5.4. Колориметрический метод определения рН
- •Характеристика индикаторов для определения рН
- •5.5. Определение титруемой кислотности
- •5.5.1. Титрование с помощью индикаторов
- •5.5.2. Электрометрическое титрование
- •5.6. Определение окислительно-восстановительного потенциала
- •5.6.1. Электрометрический метод
- •5.6.2. Колориметрический метод
- •6. Рефрактометрия
- •6.1. Измерение показателя преломления
- •6.2. Измерения с помощью рефрактометров
- •6.3. Прецизионный рефрактометр
- •6.4. Погружаемый рефрактометр
- •7. Поляриметрия
- •7.1. Устройство поляриметров
- •Удельные вращения сахаров
- •7.2. Приготовление и осветление раствора анализируемого продукта
- •7.3. Методы поляриметрического определения
- •7.4. Определение крахмала методом Эверса
- •8. Колориметрия
- •8.1. Визуальные методы
- •8.2. Фотоэлектрический метод
- •Характеристика светофильтров спектрофотометров фэк-56
- •8.3. Люминесцентный анализ
- •8.3.1. Техника эксперимента и общие приемы анализа
- •8.3.2. Применение люминесцентного анализа в исследовании пищевых продуктов
- •8.4. Цвет и его измерение
- •8.4.1.Общие понятия и приемы измерения цвета
- •8.4.2. Методики определения цветности пищевых продуктов
- •Приготовление серии растворов йода
- •9. Хроматография
- •9.1. Адсорбционная молекулярная хроматография
- •9.2. Распределительная хроматография
- •9.2.1. Хроматография на бумаге
- •9.2.2. Хроматография на колонках
- •9.2.3. Газожидкостная хроматография
- •Характеристика неподвижной фазы
- •10. Электрофорез
- •11. Спектроскопия
- •11.1. Общие понятия и терминология
- •11.2. Эмиссионный спектральный анализ
- •11.3. Анализ элементов методом пламенной фотометрии
- •11.4. Анализ элементов в дуге
- •12. Молекулярный спектральный анализ
- •12.1. Общие сведения об электронных спектрах молекул
- •12.2. Приборы для регистрации электронных спектров поглощения и техника эксперимента
- •12.2.1. Ультрафиолетовая область
- •12.2.2. Видимая область
- •12.2.3. Использование инфракрасных спектров поглощения
- •12.3. Количественный анализ по спектрам поглощения в ультрафиолетовой, видимой и инфракрасной областях спектра
- •12.3.1. Анализ однокомпонентной смеси
- •12.3.2. Анализ двухкомпонентной смеси
- •13. Масс-спектРометрия
- •14. Спектроскопия электронного парамагнитного и ядерного магнитного резонанса
- •14.1. Электронный парамагнитный резонанс
- •14.2. Ядерный магнитный резонанс
- •Контрольные вопросы
- •Список рекомендуемой литературы
- •Содержание
- •Методы исследования свойств сырья и продуктов питания
5.1. Определение активной кислотности
Концентрацию водородных ионов выражают в частях грамм-эквива-лента водорода, который равен единице. Например, при содержании ионов водорода 0,1 г/л его концентрация [H+] составит 10–1 г-экв/л.
В химически чистой воде небольшая часть ее молекул диссоци-ирована на водородные и гидроксильные ионы в равном количестве: Н2О ↔ Н+ + ОН–. При 25 C содержание диссоциированных ионов водорода и гидроксила в чистой воде одинаково и равно 10–7 моль/л; произведение обеих концентраций называется ионным произведением воды (константой диссоциации): [H+]·[OH–] = 10–7·10–7 = 10–14. Это произведение сохраняет постоянную величину и при наличии веществ, при диссоциации которых образуются водородные и гидроксильные ионы.
Вода, а также все растворы, в которых концентрация водородных и гидроксильных ионов одинакова и равна каждая 10–7 моль/л, называются нейтральными растворами.
Преобладание в растворе кислоты или щелочи приводит соответственно к возрастанию концентрации водородных или гидроксильных ионов. Однако во всех случаях их произведение остается постоянным. Поэтому вполне достаточно определить концентрацию одних ионов, чтобы найти концентрацию других. Обычно определяют концентрацию водородных ионов.
Однако надо иметь в виду, что между активностью ионов и их концентрацией в растворе существует зависимость аН+= f [H+], где f – коэффициент активности. Величина коэффициента активности зависит от природы электролита и концентрации раствора.Для чистой воды и очень разбавленных растворов f = 1, активность приблизительно равна концентрации ионов. В более концентрированных растворах между ионами возрастает электрическое взаимодействие и величина f принимает другие значения.
Концентрация водородных ионов может иметь самую разную величину от 1 до 10–14. Для удобства пользования этой величиной Сёренсен предложил характеризовать активную кислотность не абсолютной величиной концентрации водородных ионов, а десятичным логарифмом этой величины, взятым с обратным знаком, и обозначать эту величину знаком рН: [H+] = 10–pH и рН = –lg[H+].
Величину рН называют показателем водородных ионов . Она изменяется от 1 до 14. Причем при рН 7 раствор имеет нейтральную реакцию, при меньшем значении – кислую, а при большем – щелочную.
Величину рН определяют электрометрическим (потенциометрическим) или колориметрическим (индикаторным) методом. Последний метод основан на том, что некоторые вещества (так называемые индикаторы) способны менять свою окраску в зависимости от значения рН контролируемого раствора.
5.2. Электрометрический метод определения рН
Данный метод основан на том, что при погружении электрода в раствор происходит обмен ионов между электродом и раствором, вследствие чего на электроде возникает потенциал, величина которого зависит от концентрации водородных ионов в растворе.
Значение потенциала, возникающего на электродах, опущенных в электролит, и его знак зависят от природы металла электродов и растворителя, концентрации катионов в растворе. Потенциал определяется уравнением, вытекающим из закона Нерста:
Для измерения электродного потенциала ячейки составляют гальваническую цепь из опущенных в электролит измерительного и сравнительного электродов, соединенных внешней цепью. В этом случае уравнение (5.1) принимает вид
Е =
![]() ,
(5.1)
,
(5.1)
где Е0 – потенциал электрода; С – мольная концентрация катионов металлов в растворе; R – универсальная газовая постоянная; Т – абсолютная температура раствора; n – валентность металла; F = 95600 – число Фарадея.
Еяч
=
![]() ,
(5.2)
,
(5.2)
где Еи – нормальный потенциал измерительного электрода; Еср – потенциал
сравнительного электрода.
Электрод сравнения – это в основном электрод второго рода. Наиболее распространенным из этой группы является каломельный электрод (рис. 5.1, а). Он состоит из смеси 4 металлической ртути и твердого хлорида ртути (каломель), находящейся в контакте и в равновесии с насыщенным водным раствором хлорида калия 2 через отверстие 3, платинового электрода 5 и асбестовой ткани 1.
Р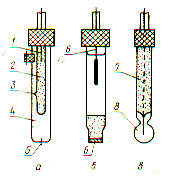 ис.
5.1. Схемы электродов для определения
рН:
ис.
5.1. Схемы электродов для определения
рН:
а – каломельные электроды; б – хлоросеребрянные электроды; в – стеклянные электроды; 1 – асбестовая ткань; 2 – раствор хлорида калия; 3 – отверстие; 4 – смесь металлической ртути и твердого хлорида; 5 – платиновый электрод; 6 – диск из оплавленного стекла; 7 – трубка; 8 – чувствительная мембрана
Другим важным электродом сравнения является хлоросеребряный электрод (см. рис. 5.1, б). Он представляет собой аналог каломельного электрода, за исключением того, что вместо ртути и хлорида ртути в нем находятся серебро и хлорид серебра, а асбестовая ткань заменена на диск из оплавленного стекла 6.
Из измерительных наиболее распространен стеклянный электрод (см. рис. 5.1, в). Это объясняется его большими метрологическими, конструктивными, эксплуатационными преимуществами перед другими электродами. Электрод представляет собой трубку 7 из обычного стекла, на конце которой напаяна чувствительная мембрана 8 (плоская, конусообразная или сферическая) из специального электродного стекла. Мембрана выполняет функции одновременно двух электродов, аналогичных водородному: наружного, соприкасающегося с контролируемым раствором, и внутреннего, соприкасающегося с раствором, имеющим известный состав и постоянное значение рН. Контакт между обоими электродами осуществляется через мембрану, обладающую высоким электрическим сопротивлением, значение которого зависит от поверхности, толщины, химического состава стекла и температуры.
Таким образом, потенциал стеклянного электрода является алгебраической суммой потенциалов внутренней и наружной поверхностей измерительной мембраны. Для измерения необходимо рН раствора с какой-либо стороны мембраны поддерживать строго постоянным. В этом случае суммарный потенциал стеклянного электрода будет являться функцией рН второго, контролируемого раствора.
Основными достоинствами стеклянных электродов являются простота в работе, быстрое установление равновесия и возможность определения рН в окислительно-восстановительной среде. К недостаткам относят хрупкость их конструкций и усложнение работы при переходе к сильнощелочным и сильнокислотным растворам.
Для обеспечения механической прочности электродов, особенно при использовании в производственных условиях, их армируют, для чего применяют различные конструкции (в зависимости от решаемой задачи) из полимерных материалов при коррозиестойкой стали.
При измерении ЭДС гальванического элемента через элемент практически не должен протекать ток, так как его прохождение вносит две погрешности в значение ЭДС: во-первых, из-за изменения концентрации потенциалопередающих частиц у поверхности каждого электрода; во-вторых, из-за того, что каждый элемент обладает внутренним сопротивлением и на нем происходит падение напряжения, которое в зависимости от направления тока либо уменьшает, либо увеличивает ЭДС системы.
Наиболее удовлетворительные результаты дают измерения с помощью потенциометра. Воспроизводимость любого такого измерения зависит в основном от чувствительности, с которой известную переменную ЭДС можно компенсировать ЭДС гальванического элемента. Эта чувствительность определяется прибором, применяемым для обнаружения очень слабых токов, которые текут через цепь, когда две противоположно направленные ЭДС недостаточно компенсированы.
Прибор рН-метр прямого отсчета представляет собой вольтметр с высоким входным сопротивлением, измеряющий ЭДС гальванического элемента и преобразующий ее в пропорциональный ей ток, который проходит через амперметр. Шкала такого амперметра градуирована непосредственно в единицах рН. Прибор рН-метр (потенциометрический или с нуль-прибо-ром) состоит из цепи, примерно аналогичной примененной в обычном потенциометре, за исключением того, что гальванометр заменен полупроводниковым усилителем. В результате этого при потенциометрическом компенсировании можно легко обнаружить токи менее 10–12А.
Погрешность рН-метров прямого отсчета обычно составляет до ±0,1 рН. Приборы рН-метры с нуль-прибором обеспечивают погрешность измерения (0,01…0,02) рН.
В практике измерений составляют гальванический элемент из стеклянного измерительного и каломельного сравнительного электродов. Для такой системы суммарная ЭДС связана с рН раствора соотношением
Е = Е0 + 0,059 рН, (5.3)
где Е0 определяется составом гальванического элемента. Его значение находят экспериментальным путем для каждой измерительной ячейки с помощью стандартного раствора, называемого буферным. Чтобы инструментальное определение рН было действительно правильным, значение Е0 должно быть постоянным. Для этого на практике следует подобрать рН стандартного буфера как можно ближе к рН неизвестной пробы.
В конечном счете точность измерения рН определяется постоянством параметра Е0. Для оптимальных условий, когда значения рН стандартного буфера и раствора неизвестной пробы идентичны, погрешность измерения рН неизвестного раствора может составить приблизительно ±0,02 рН.
Стеклянный мембранный электрод обычно менее чувствителен к помехам по сравнению с другими электродами. Однако он обладает некоторыми особенностями, которые ограничивают его применение в определенных средах. Так, в растворах, содержащих высокие концентрации ионов щелочных металлов, стеклянный мембранный электрод имеет так называемую щелочную погрешность. Эта погрешность возникает из-за того, что катионы, в особенности ионы натрия и в меньшей степени ионы лития и калия, конкурируют с ионами водорода за ионообменные центры на поверхности внешнего гидратированного гелевого слоя, в результате чего потенциал на поверхности раздела фаз изменяется на величину, называемую, диффузионным потенциалом. Жидкостный диффузионный потенциал может составлять (1…2) мВ, т. е. иметь значение, которое существенно влияет на правильность результатов, полученных прямым измерением.
Для уменьшения жидкостного диффузионного потенциала до приемлемого уровня между растворами обычно помещают солевой мостик, содержащий насыщенный раствор хлорида калия, потому что хлорид-ионы имеют близкие значения подвижности и проявляют тенденцию мигрировать через жидкостные соединения почти с одинаковой скоростью.
В большинстве случаев при использовании прямой потенциометрии для аналитических целей применяют эмпирическую калибровку, которая сводит к минимуму погрешности, возникающие из-за ненадежности определения потенциала электрода сравнения и жидкостных диффузионных потенциалов.
