
- •1.2 Періодичний закон і періодична система елементів.
- •1. Енергія і розмір орбіталі і електронної хмари характеризуються головним квантовим числом n.
- •2. Форма орбіталей і хмар характеризується побічним (орбітальним) квантовим числом l.
- •3. Магнітне квантове число m I характеризує напрям орбіталей (електронних хмар) в просторі.
- •3. Соли, утворені слабкою кислотою і слабкою основою.
- •1. Сіль містить комплексний катіон
- •2. Сіль містить комплексний аніон
- •Кальцій
- •Токсична дія
- •2. Токсична дія
3. Магнітне квантове число m I характеризує напрям орбіталей (електронних хмар) в просторі.
Магнітне квантове число приймає значення цілих чисел від - l через 0 до +l.
Число значень mi, визначає число орбіталей на підрівні; наприклад:
s-підрівень: l = 0; → mi = 0 → 1 орбіталь (мал. 2).
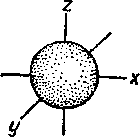
Мал. 2. Форма і напрям s-електронної орбіталі
р-підрівень: l = 1; → m1 = - 1, 0 , +1 → 3 орбіталі.
Всі три р-орбіталі взаємно перпендикулярні, вони направлені уздовж осей просторових координат, тому їх часто позначають як рx-, ру - і рz-орбіталі. Таке позначення указує просторову спрямованість р-орбіталей (мал. 3).

Мал. 3. Форма і напрям p - електронних орбіталей
Ще складніші форми, ніж р-орбіталі, мають d-орбіталі (їх п'ять) і f-орбіталі (їх сім).
Число орбіталей на підрівні рівне: 2l + 1.
Графічно будь-яка орбіталь зображується у вигляді клітки (квантового осередку) :
s - підрівень:
p - підрівень:
d - підрівень:
f-підрівень:
Загальне число орбіталей на енергетичному рівні Nорб. = n2
Отже, кожна орбіталь і електрон, який знаходиться на цій орбіталі, характеризуються трьома квантовими числами: головним n, побічним l і магнітним mi.
Електрон характеризується ще одним - квантовим числом спину (від англ. to spin - кружляти, обертати).
4. Спинове квантове число (спин електрона) спину ms характеризує обертання електрона навколо своєї осі і приймає тільки два значення: + ½ і - ½ .
Схемно це можна показати так:

Електрон зі спином + ½ умовно зображають так: ↑; із спином - ½ - ↓.
Принцип Паулі свідчить:
В атомі не може бути двох електронів з однаковим набором всіх чотири
квантових чисел.
Тому на одній орбіталі не може бути більше двох електронів; ці два електрони мають однаковий набір трьох квантових чисел (n, l, mi) і повинні відрізнятися спинами (квантовим числом спину ms) : ↑↓ ( таблиця 3)
Таблиця 3
Головне квантове число, типи і число орбіталей і максимальне число
електронів на підрівнях і рівнях
-
Енергетичний рівень, n
Число підрівнів, дорівнює -n
Орбіталі
Число орбіталей
Максимальне число
електронів
У підрівні
У рівні, яке дорів-нює n2
У підрівні
У рівні
K (n=1)
1
1s
1
} 1
2
2
L (n=2)
2
2s
2p
1
3
} 4
2
6
} 8
M (n=3)
3
3s
3p
3d
1
3
5

9
2
6
10
18
N (n=4)
4
4s
4p
4d
4f
1
3
5
7

16
2
6
10
14
32
Два електрони, які знаходяться на одній орбіталі, називаються спареними (або неподіленою електронною парою).
Спарені електрони є електронами з протилежними (антипаралельними) спинами.
↑
↓
Загальне число електронів на енергетичному рівні Nел=2n2.

Біонеоганічна хімія
Лекція № 2 . Вчення про розчини
2.1 Роль розчинів у життєдіяльності організмів. Механізм процесів розчинення.
Термодинамічний підхід до процесу розчинення. Розчинність речовин.
2.2 Розчинність газів у рідинах. Залежність розчинності газів від тиску (закон
Генрі—Дальтона), природи газу та розчинника, температури. Вплив
електролітів на розчинність газів (закон Сєченова). Розчинність газів у крові.
Кесонна хвороба.
2.3 Розчинність рідин та твердих речовин у рідинах. Залежність розчинності від
температури, природи розчинної речовини та розчинника. Розподіл речовини
між двома рідинами, що не змішуються. Закон розподілу Нернста та його
значення в явищі проникності біологічних мембран.
Самостійна робота : Способи вираження кількісного складу розчинів.
2.1.Роль розчинів у життєдіяльності організмів. Механізм процесів
розчинення. Термодинамічний підхід до процесу розчинення. Розчинність
речовин.
Розчини відіграють надзвичайно велике значення в природі Практично вся природа є нічим іншим, як хімією розчинів. Біологічні процеси в рослинах, живих організмах протікають у розчинах. В техніці також дуже багато процесів здійснюється в розчинах. Так, одержання різних солей, кислот, лугів, мінеральних добрив тощо здійснюється теж в розчинах Розчин - це суміш по меншій мірі двох речовин, одна з яких є розчинником. Другим компонентом може бути газ, тверда речовина або рідина
Вивчення властивостей розчинів показує, що їх поведінка підкоряється ряду законів, які необхідно враховувати в медичній практиці.
Розчином називають, ту що знаходиться в стані рівноваги, гомогенну
систему змінного складу з двох або більш речовин.
Речовини, складові розчина, називають компонентами розчину.
По агрегатному стану розчини можуть бути газоподібними, рідкими і твердими . Наприклад, суміші газів (повітря) є газоподібними розчинами; розчини солей у воді - рідкими; сплави золота з міддю, нікелю з міддю - твердими розчинами.
Для медиків найбільший інтерес представляють рідкі водні розчини.
Будь-який розчин складається з розчинених речовин і розчинника, хоча ці поняття до певної міри умовні. Наприклад, залежно від співвідношення кількостей спирту і води ця система може бути розчином спирту у воді або води в спирті.
Зазвичай розчинником вважають той компонент, який у розчині знаходиться в тому ж агрегатному стані, що і до розчинення. Наприклад, у водному розчині глюкози (тверда речовина) розчинником вважається вода.
У розчинах електролітів незалежно від співвідношення компонентів електроліти розглядаються як розчинені речовини (наприклад, 96 %-вий розчин сірчаної кислоти у воді).
Значення розчинів в життєдіяльності організмів. Багато динамічних процесів протікають лише за умови, що речовини, що беруть участь в них, знаходяться в розчиненому стані. Вчення про розчини представляє для медиків особливий інтерес тому, що найважливіші біологічні рідини - кров, лімфа, сечовина, слина, піт є розчинами солей, білків, вуглеводів, ліпідів у воді. Засвоєння їжі пов'язане з переходом поживних речовин у розчинений стан. Біохімічні реакції в живих організмах протікають в розчинах.
Біорідини беруть участь в транспорті поживних речовин (жирів, амінокислот, кисню), лікарських препаратів до органів і тканин, а також у виведенні з організму метаболітів -(сечовини, білірубіну, вуглекислого газу і т. д.). Склад деяких біологічних рідин приведений в табл.1. Плазма крові є середовищем для кліток - лімфоцитів, еритроцитів, тромбоцитів.
У рідких середовищах організму підтримується постійність кислотності, концентрації солей і органічних речовин. Така постійність називається концентраційним гомеостазом.
Таблиця 1.
Йонний склад деяких біорідин , ммоль/л
Біорідина
|
Na+ |
K+ |
Ca2+ |
Cl - |
HCO3- |
Вагова доля бі-лку, % |
Плазма крові |
140 |
5 |
2,5 |
105 |
27 |
6 - 8 |
Цереброспінальна рідина |
140 |
3 |
1,3 |
120 |
21 |
0,03 |
Синовіальна рідина |
140 |
4 |
- |
120 |
25 |
0,03 |
Асцитична рідина |
135 |
3,5 |
1,8 |
105 |
30 |
- |
Піт |
75 |
5 |
2,5 |
75 |
- |
- |
Сльози |
140 |
5 |
- |
115 |
20 |
0,8 |
Слина |
60 - 100 |
7 - 20 |
1,5 - 4 |
60 - 80 |
10 - 20 |
0,5 |
Шлунковий сік |
20 - 60 |
6 - 7 |
- |
145 |
- |
0,5 |
Панкреатичний сік |
150 |
7 |
3 |
80 |
80 |
1,2 |
Сечовина |
150 |
36 |
5 |
160 |
- |
- |
Природа процесу розчинення складна. Природно виникає питання, чому деякі речовини легко розчиняються в одних розчинниках і погано розчинні або практично не розчиняються в інших.
Утворення розчинів завжди пов'язане з тими або іншими фізичними процесами. Одним з таких процесів є дифузія розчиненої речовини і розчинника. Завдяки дифузії частинки - молекули, іони - віддаляються з поверхні речовини, що розчиняється, і рівномірно розподіляються за всім обсягом розчинника. Саме тому у відсутність перемішувань швидкість розчинення залежить від швидкості дифузії. Проте не можна лише фізичними процесами пояснити неоднакову розчинність речовин в різних розчинниках.
Великий російський хімік Д. І. Менделєєв (1834-1907) вважав, що важливу роль при розчиненні відіграють хімічні процеси. Він довів існування гідратів сірчаної кислоти H2SO4 . Н2O, H2SO4 . 2H2O, H2SO4 . 4H2O і деяких інших речовин, наприклад С2H5OH . ЗH2O. У цих випадках розчинення супроводжується утворенням хімічних зв'язків частинок речовини, що розчиняється, і розчинника. Цей процес називається сольватацією; у окремому випадку, коли розчинником є вода, - гідратацією.
Як встановлено, залежно від природи розчиненої речовини сольвати (гідрати) можуть утворюватися в результаті фізичних взаємодій: іон-діпольної взаємодії, наприклад, при розчиненні речовин з іонною структурою (NаС1 і ін.); діполь-діпольного взаємодії - при розчиненні речовин з молекулярною структурою (органічні речовини).
Хімічні взаємодії здійснюються за рахунок донорно - акцепторних зв'язків - тут іони розчиненої речовини є акцепторами електронів, а розчинники (Н2О, NН3) -донорами електронів (наприклад, утворення аквакомплексів), а також в результаті утворення водневих зв'язків (наприклад, розчинення спирту у воді).
Доказами хімічної взаємодії розчиненої речовини з розчинником є теплові ефекти і зміна забарвлення, супроводжуючі розчинення.
Наприклад, при розчиненні калія гідроксиду у воді виділяється теплота:
КОН + хН2О = КОН (Н2О)х; ∆Но раств = -55 кДж/моль
а при розчиненні натрію хлориду теплота поглинается:
NаС1 +xН2О = NаС1 (Н2О)x; ∆Но раств = +3,8 кДж/моль
Теплоту, що виділяється або поглинається при розчиненні 1 моль речовини, називають теплотою розчинення Q розч.
Відповідно до 1-го початку термодинаміки
Qрозч. = ΔНо розч.
Де ΔНо розч. - зміна ентальпії при розчиненні даної кількості речовини.
Розчинення у воді безводного міді сульфату білого кольору призводить до появи інтенсивного блакитного забарвлення. Утворення сольватів, зміна забарвлення, теплові ефекти, як і інших фактів, свідчать про зміну хімічної природи компонентів розчину при його виникненні.
Таким чином, відповідно до сучасних уявлень розчинення - фізико-хімічний процес, в якому грають роль як фізичні, так і хімічні взаємодії.
2.2 Розчинність газів у рідинах. Залежність розчинності газів від тиску
(закон Генрі—Дальтона), природи газу та розчинника, температури.
Вплив електролітів на розчинність газів (закон Сєченова). Розчинність
газів у крові. Кесонна хвороба.
Розчинність газів в рідинах. Закони Генрі, Дальтона і Сєчєнова. Розчинення газів в рідинах майже завжди супроводжується виділенням теплоти (ентальпія ΔН< 0). Тому розчинність газів з підвищенням температури згідно принципу Ле -шателье знижується. Цю закономірність часто використовують для видалення розчинених газів з води, наприклад СО2, кип'ятінням. Іноді розчинення газу супроводжується поглинанням теплоти, наприклад розчинення благородних газів в деяких органічних розчинниках. В цьому випадку підвищення температури збільшує розчинність газу.
Газ не розчиняється в рідині безмежно. При деякій концентрації газу X встановлюється рівновага:
Х(г) ↔ Х(р)
При розчиненні газу в рідині відбувається значне зменшення об'єму системи. Тому підвищення тиску, згідно принципу Ле - Шателье, повинне приводити до зсуву рівноваги управо, тобто до збільшення розчинності газу. Якщо газ малорозчинний в даній рідині і тиск невеликий, то розчинність газу пропорційна його тиску. Ця залежність виражається законом Генрі (1803):
кількість газу, розчиненого при даній температурі у визначеному об'ємі рідини, при рівновазі прямо пропорційно тиску газу.
Закон Генрі може бути записаний в наступній формі:
с(Х) → Кг(Х)р(Х), ( 2,1)
де с (X) - концентрація газу в насиченому розчині, моль/л; р(Х) -тиск газу X над розчином, Па; КГ(Х) - постійна Генрі для газу X, моль.л-1.Па-1. Константа Генрі залежить від природи газу, розчинника і температури .
Закон Генрі справедливий лише для порівняно розбавлених розчинів, при невисокому тиску і відсутності хімічної взаємодії між молекулами газу, що розчиняється, і розчинником.
Так, СО2 і NНз вступають в хімічну взаємодію з водою, а НС1 дисоціює у воді, що різко підвищує розчинність цих газів. При високому тиску розчинність газу може досягти максимуму, пов'язано з тим, що при дуже високому тиску зміна об'єму рідині унаслідок розчинення в ній газу стає сумірною з об'ємом розчиненого газу.
Закон Генрі є окремим випадком загального закону Дальтону. Якщо йдеться про розчинення не однієї газоподібної речовини, а суміші газів, то розчинність кожного компоненту підкоряється закону Дальтону:
розчинність кожного з компонентів газової суміші при постійній температурі пропорційна парціальному тиску компоненту над рідиною і не залежить від загального тиску суміші і індивідуальності інших компонентів.
Інакше кажучи, у разі розчинення суміші газів в рідині математичний вираз закону Генрі замість р (X) підставляють парціальний тиск рi, даного компоненту.
Під парціальним тиском компоненту розуміють частку тиску компоненту від загального тиску газової суміші:
рi / рзагальний
Парціальний тиск компонента розраховують за формулою:
рi = рзагальн. . х(Хi)
де рi - парціальний тиск компоненту Xi; рзагальн. - загальний тиск газової суміші; х(Хi) - молярна частка 1-го компоненту.
Приклад. Повітря є сумішшю, що полягає, в основному, з трьох газів: 78% азоту, 21 % кисню і 1 % аргону (за об'ємом). Визначите концентрацію азоту у воді при 298 К, якщо постійна Генрі рівна 6,13.10-9 моль . л-1 . Па-1.
Оскільки повітря містить 78 % азоту за об'ємом, парціальний тиск азоту в повітрі при 101 325 Па складає 79033,5 Па (об'ємна частка азоту рівна молярній частці азоту, звідси р(N2)= рзагальн 0,78). З рівняння (2.1) слідує с (N2) = Kr(N2) р(N2), звідси с (N2) = 6,13. 10-9. 79033,5 = 4,84.10-4 моль/л.
Вивчаючи розчинність газів в рідинах у присутності електролітів, російський лікар-фізіолог І. М. Сєченов (1829 - 1905) встановив наступну закономірність (закон Сєченова):
розчинність газів в рідинах у присутності електролітів знижується; відбувається висолювання газів.
Математичний вираз закону Сєченова має наступний вигляд:
с(Х)=сo(Х)е-Kc се (2.2)
де с (X) - розчинність газу X у присутності електроліту; сo(Х) - розчинність газу X в чистому розчиннику; се - концентрація електроліту; е - основа натурального логарифму; Кс - константа Сєченова, залежна від природи газу, електроліту і температури.
Одною з причин, що приводить до зменшення розчинності газів, у присутності електролітів, є гідратація (сольватація) іонів електролітів молекулами розчинника. В результаті цього процесу зменшується число вільних молекул розчинника, а отже, знижується його розчинювальна здатність.
Біологічне значення законів Генрі – Дальтона і Сєченова. Закони Генрі – Дальтона і Сєченова мають велике практичне значення як в хімії, так і в медицині. Зміна розчинності газів в крові при зміні тиску можуть викликати важкі захворювання.
 Кесонна
хвороба,
від якої зазвичай страждають водолази,
- прояв
закону Генрі. На глибині, наприклад, 40
м нижче за
рівень морить загальний тиск підвищується
приблизно в 4 рази і складає близько
400 кПа.
Розчинність азоту в плазмі крові при
такому тиску відповідно до закону Генрі
в 4 рази більше, ніж на поверхні моря.
Якщо піднімати водолаза дуже
швидко на поверхню, то тиск в легенях
різко знижується
і, отже, значно знижується розчинність
газів в плазмі крові. Внаслідок цього
частина газів виділяється з
крові у вигляді бульбашок. Ці бульбашки
газів закупорюють дрібні
судини в різних органах і тканинах
(емболія), може
привести до важкого ураження тканин і
навіть загибелі
людини. Аналогічна картина може виникнути
і в результаті різкого
зменшення тиску при розгерметизації
скафандрів
льотчиків-висотників, кабін літаків і
апаратів,
що спускаються
(мал.
2.9, б).
Кесонна
хвороба,
від якої зазвичай страждають водолази,
- прояв
закону Генрі. На глибині, наприклад, 40
м нижче за
рівень морить загальний тиск підвищується
приблизно в 4 рази і складає близько
400 кПа.
Розчинність азоту в плазмі крові при
такому тиску відповідно до закону Генрі
в 4 рази більше, ніж на поверхні моря.
Якщо піднімати водолаза дуже
швидко на поверхню, то тиск в легенях
різко знижується
і, отже, значно знижується розчинність
газів в плазмі крові. Внаслідок цього
частина газів виділяється з
крові у вигляді бульбашок. Ці бульбашки
газів закупорюють дрібні
судини в різних органах і тканинах
(емболія), може
привести до важкого ураження тканин і
навіть загибелі
людини. Аналогічна картина може виникнути
і в результаті різкого
зменшення тиску при розгерметизації
скафандрів
льотчиків-висотників, кабін літаків і
апаратів,
що спускаються
(мал.
2.9, б).
Останнім часом при лікуванні газової гангрени і ряду інших захворювань, при яких накопичуються мікроби в тканинах, що омертвіли, застосовують гіпербаричну оксигенацію, тобто поміщають хворих в барокамери з підвищеним тиском кисню в повітрі: При цьому поліпшується постачання тканин киснем і у багатьох випадках такий спосіб лікування дає добрі результати.
Проявом закону Генрі – Дальтона і моделлю емболії є утворення рясної піни при відкупорюванні пляшки шампанського або газованої води. Тут має місце пониження розчинності і виділення вуглецю діоксиду СО2 при пониженні його парціального тиску.
Відповідно до закону Сєченова не тільки електроліти, але і білки, ліпіди і інші речовини, вміст яких в крові може мінятися у відомих межах роблять істотний вплив на розчинність кисню і вуглецю діоксиду в крові.
2.3 Розчинність рідин та твердих речовин у рідинах. Залежність
розчинності від температури, природи розчинної речовини та
розчинника. Розподіл речовини між двома рідинами, що не змішуються.
Закон розподілу Нернста та його значення в явищі проникності
біологічних мембран.
Розчинність твердих і рідких речовин в рідинах. При розчиненні твердих і рідких речовин у воді об'єм системи зазвичай змінюється трохи, тому тиск практично не впливає на розчинність таких речовин. Тільки при дуже високому тиску цей вплив стає помітним. Так, наприклад, розчинність NН4 NO3 у воді знижується майже удвічі при підвищенні тиску до 106 кПа.
Залежність розчинності твердих речовин від температури визначається знаком і числовим значенням теплоти розчинення ΔH розчин. .
Якщо до рівноважної системи «тверда речовина + розчинник» (насичений розчин) застосувати принцип Ле - Шателье, то можна прийти до висновку: у тих випадках, коли процес розчинення є ендотермічним (ΔН > 0), підвищення температури приводить до збільшення розчинності. Коли розчинення - процес екзотермічний (ΔН <0), із зростанням температури розчинність знижується.
Зручно залежність між розчинністю і температурою зображати графічно у вигляді кривих розчинності.
При змішенні двох рідин можливі три варіанти: 1) необмежена розчинність; 2) обмежена розчинність; 3) практично повна нерозчинність.
Наприклад, спирт і вода необмежено розчинні один в одному, інакше кажучи, утворюють гомогенну (однофазну) систему при змішенні в будь-яких пропорціях.
Обмежена розчинність рідин спостерігається, наприклад, при змішенні води
і аніліну, води і фенолу, аніліну і гексану. Так, якщо змішати анілін і гексан при кімнатній температурі, то утворюються два шара: верхній є насиченим розчином аніліну в гексані, і нижній - насичений розчин гексану в аніліні.
З підвищенням температури розчинність аніліну в гексані і гексану в аніліні збільшується до тих пір, поки буде досягнута температура, вище за яку утворюються гомогенні анілін-гексанові розчини. Зростання взаємної розчинності обумовлюється ендотермічністю (ΔН розчин.> 0) процесу розчинення.
Склад суміші гексану і аніліну зручно виразити в молярних долях компонентів х(Х1), що змінюються від 0 до 1. Тоді для всіх сумішей виконується співвідношення :
х(С6Н14) + х(С6Н5NН2) = 1 или х(С6Н14) = 1 - х(С6Н5NН2)

Діаграма залежності взаємної розчинності цих рідин від температури набуває компактного вигляду.
Температуру, вище за яку взаємна розчинність рідин стає необмеженою при будь-яких їх співвідношеннях, називають верхньою критичною температурою розчинення Ткр.
Так, вище Ткр = 333 К анілін і гексан стають необмежено розчинними один в одному при будь-яких співвідношеннях.
Прикладом практично повністю нерозчинних один в одному рідин є бензол і вода.
Біологічна роль розчинності речовин перш за все пов'язана із здатністю їх проходити через біологічні мембрани. При транспорті чужорідних для живих організмів сполук - лікарських препаратів і їх метаболітів за допомогою простої дифузії тільки жиророзчинні неіонізовані молекули легко проходять через мембрани (мал. 2.8). Внаслідок цього неелектроліти транспортуються відповідно до їх розчинності в ліпідах (відносяться до головних компонентів мембран), а електроліти - відповідно до ступеня їх дисоціації і розчинності в ліпідах недиссоційованих молекул.
У посудині з двома рідинами, що не змішуються, відбувається розподіл доданої в посудину речовини між рідинами пропорційно його розчинності в кожній з них. Розподіл речовин між двома рідинами, що не змішуються , підкоряється закону Нернста - Шилова:
при постійній температурі відношення рівноважних концентрацій розчиненої речовини, що розподілилася між двома рідинами (фазами), що не змішувалися, є величиною постійною, не залежною від загальної кількості компонентів:
Сα(Х)
Кн(Х) = ---------
Сβ(Х)
де Кн (X) - коефіцієнт розподілу речовини X, не залежний від концентрації; Сα (Х), Сβ (Х) - молярні концентрації розчиненої речовини X у фазах α та β відповідно.
Закон застосовний у такому вигляді, коли розчинена речовина дисоціює і не асоціює ні в одній з фаз. У подібних випадках обмеження може бути усунене урахуванням впливу цих реакцій на концентрацію розчиненої речовини.
Проте на практиці зручніше користуватися загальним коефіцієнтом розподілу:
[загальна концентрація усіх форм X] α
Кон(Х) = ----------------------------------------------------
[загальна концентрація усіх форм X] β
Де К°н (X) - загальний коефіцієнт розподілу, α та β - фази. Для речовин-неелектролітів, які не дисоціюють жодною з фаз, Кн (X) = К°н (X) і К°н (X) не залежить від кислотності середовища (рН). Для речовин-електролітів К°н (X) залежить кислотності середовища.
Якщо, наприклад, до двофазної системи вода (α) - тетрахлорид вуглецю (β) додати деяку кількість йоду, збовтати і дати рідини відстоятися, то після встановлення рівноваги при кімнатній температурі концентрація йоду в ССl (малиновий шар) опиниться в 85 разів більше, ніж у воді (жовтий шар) (мал. 2.20), тобто коефіцієнт розподілу йоду
Сβ(I2)
В системі СС14—Н2О Кн (I2) = ------ = 85.
Сα(I2)
Метод витягання одного з компонентів розчину за допомогою розчинника, що не змішується з розчином, називають екстракцією.
Екстракцію широко використовують для розділення лікарських препаратів і їх метаболітів, а також для виділення цих сполук з біологічних рідин.
 Значення
закону розподілу для визначення
проникності біологічних
мембран.
Значення
закону розподілу для визначення
проникності біологічних
мембран.
У розподілі речовин в організмі величезну роль грає їх здатність дифундувати через біологічні мембрани. Проте легко проникають через мембрани тільки неіонізовані молекули жиророзчинних речовин.
Здатність таких речовин транспортуватися через мембрани приблизно пропорційна знайденим in vitro (у колбі) значенням коефіцієнтів розподілу цих речовин в системах «масло-вода»: октанол - вода, оливкове масло - вода, хлороформ - вода. Тому коефіцієнти розподілу випробовуваних препаратів в цих системах і їх залежність від кислотності середовища дозволяють прогнозувати можливість проникнення цих препаратів через біологічні мембрани (біологічна доступність) .
Самостійна робота : Способи вираження кількісного складу розчинів.
Важливою характеристикою розчину є концентрація. Цій величиною визначаються багато властивостей розчинів.
Концентрацією речовини - компоненту розчину - називають величину, вимірювану кількістю розчиненої речовини, що міститься в певній масі або об'ємі розчину або розчинника.
Найбільш часто вживані способи виразу концентрації: масова частка, молярна, моляльна, молярна концентрація еквівалента, молярна частка, об'ємна частка, титр.
Масову частку ω (Х) виражають в долях одиниці, відсотках ( %), проміле (тисячна частина відсотка) і в мільйонних долях (млн.-1). Масову частку розраховують по формулах:
т(Х)
ω(Х) = ------------ , або . 100%
т(р-на)
где т (X) —масса даного компонента X (розчиненої речовини), кг (г); т (р-на) — маса розчина, кг (г).
Молярну концентрацію с(X) виражають в моль/м3, моль/дм3, моль/см3, моль/л, моль/мл. У медицині переважно застосування одиниць моль/л. Молярну концентрацію розраховують за формулою :
n(Х) m (X)
с(Х) = ------------ = ----------------- ,
V(р-ну) M(X) V(p-ну)
де n (X) - кількість розчиненої речовини системи, моль; М (X) - молярна маса розчиненої речовини, кг/моль або г/моль; m (X) - маса розчиненої речовини відповідно, кг або г; V (р-ну) -об'ем розчину, л.
Моляльну концентрацію b (X) виражають в одиницях моль/кг. Форма запису, наприклад: b (Нс1) =0,1 моль/кг. Розраховують моляльну концентрацію по формулі :
n(Х) m (X)
b(Х) = ------------ = ----------------- ,
m(р-ка) M(X) т(p-ка)
де т (р-ка) --- масса розчинника, кг.
У хімії широко використовують поняття еквівалента і чинника еквівалентності. Еквівалентом називають реальну або умовну частинку речовини X, яка в даній кислотний-основній реакції еквівалентна одному іону водню або в даній окислювально-відновній реакції - одному електрону, або в даній обмінній реакції між солями - одиниці заряду.
Відповідно для розчинів використовують поняття молярної концентрації еквівалента.
Чинник еквівалентності fекв(Х) - число, що позначає, яка частка реальної частинки речовини X еквівалентна одному іону водню в даній кислотний-основній реакція або одному електрону в даній окислювально-відновній реакції , або одиниці заряду в даній обмінній реакції між солями.
Чинник еквівалентності розраховують на основі стехиометрії даної реакції з рівності:
fэкв(Х) = 1/z
де z - основність кислоти або кислотність підстави, даній кислотний-основній реакції, а також число електронів, що приєднуються або втрачаються частинкою в даній окислювально-відновній реакції.
У обмінних реакціях без участі протонів z - сумарний заряд іонів, що обмінюються, в молекулі речовини, що бере участь в конкретній хімічній реакції; z - величина безрозмірна.
Молярною масою еквівалента речовини X (маса одного моля еквівалента речовини) називають величину, вимірювану добутком чинника еквівалентності на молярну масу речовини X
М (1/z Х) = 1/z М (Х)
де М (1/z Х) – молярная маса еквівалента.
Одиниці вимірювання молярної маси еквівалентів - кг/моль, г/моль.
Молярну концентрацію еквівалентів (нормальну концентрацію) позначають с(1/z Х). Одиниці її вимірювання - моль/м3, моль/дм3, моль/см3, моль/л, моль/мл. У медицині частіше використовують одиницю моль/л.
Форма запису, наприклад, с(1/5 КМnО4)= 0,1 моль/л.
Молярну концентрацію еквівалента, розраховують по формулі
n(1/z Х)
с(1/z Х) = ------------ ,
V(р-на)
де n(1/z Х) - кількість речовини еквівалентів, моль; V (р-на) — об’ем розчина, л.
Молярна концентрація и молярна концентрація еквівалентів пов’язані співвідношенням:
с(1/z Х) = сz (Х)
Молярну частку х (Xi) виражають в долях одиниці, або у відсотках. Молярную частку розраховують по формулі -
n( Хi)
х(Хi) = ------------ ,
∑n (р-на)
де n (Xi) — кількість речовини данного компоненту, моль; ∑n (р-на) — cумарна кількість усіх компонентів розчина, моль.
Об’емна частка φ(Х) выражають у частках одиниці або у процентах, її розраховують за формулою
V(Х)
φ (Х) = ------------ , 40 0 = 40%
V(р-на)
де V (X) —об’ем данного компонента X розчина, а V(р-р) —загальний об’ем розчина, зазвичай на 10 мл.
Титр розчину позначають Т(Х), одиниця виміру- кг/см3, г/см3, г/мл. Титр розчину можна розрахувати по формулі
т(Х)
Т (Х) = ------------ ,
V(р-на)
де т (X) — масса речовини, зазвичай г; V(р-на) — об’ем розчина, мл.
У клінічній практиці нерідко виражають концентрацію іонів в міліграм відсотках (мг%). Це маса речовини, виражена в міліграмах на 100 мл розчину.
Біонеоганічна хімія
Лекція № 3 . Кислотно-основна рівновага в біологічних
рідинах
3.1 Розчини електролітів.
3.2 Електроліти, в організмі людини.
3.3 Ступінь та константа дисоціації слабких електролітів.
3.4 Властивості розчинів сильних електролітів.
3.5 Активність та коефіцієнт активності. Йона сила розчину.
Водно-електролітний баланс - необхідна умова гомеостазу.
Самостійна робота: Сильні та слабкі електроліти
3.1 Розчини електролітів.
Поведінка розведених розчинів неелектролітів добре описується законами Вант-Гоффа та Рауля. Виявилось, що для розчинів електролітів (кислот, основ, солей) ці закони порушуються: осмотичний тиск значно вищий, ніж це випливає з рівняння Вант-Гоффа, а точка кипіння і замерзання таких розчинів теж суттєво відрізняється від розрахованих значень для розчинів неелектролітів такої самої концентрації
Відхилення у поведінці розчинів електролітів Вант-Гофф спробував пояснити за допомогою коефіцієнта i, введення якого у рівняння для осмотичного тиску дає можливість знайти осмотичний тиск Росм для розчину електроліту з концентрацією с:
Росм = icRT
Виходячи з цього рівняння, множник , який він назвав ізотонічний коефіцієнтом, показує, у скільки разів експериментальне визначений осмотичний тиск розчину у електроліту Рексп більше за розрахований Рразр для неелектроліту з тою самою концентрацією:
Р експ
і = -----------
Р розр
Пояснити відмічені відхилення у поведінці розчинів електролітів від законів Вант-Гоффа і Рауля вдалося тільки за допомогою теорії електролітичної дисоціації та теорії сильних електролітів.
Сванте Арреніус(1883) сформулював теорію електролітичної дисоціації.
Згідно цієї теорії, процес розпаду речовин в розчині на іони називається електролітичною дисоціацією. Кислоти - це речовини, що дисоціюють на іон гідрогену (Н+) і аніон, а основи - сполуки, які при дисоціації дають гідроксил-іон (ОН-) та катіон. Процесом нейтралізації називають реакцію сполучення іонів Н+ з іонами ОН-, внаслідок чого утворюється вода.
Сіль - сполука, що дисоціює на катіон і аніон. Солі в розчинах дисоціюють на іони повністю, тоді як кислоти і основи дисоціюють не повністю. Внаслідок дисоціації встановлюється рівновага між продисоційованими іонами та недисоційованими молекулами, яка виражається за допомогою константи рівноваги і називається константою дисоціації.
Електролітична дисоціація водних розчинів слабких електролітів- оборотний процес: у кожний даний момент за рахунок розпаду молекул утворюються іони (іонізація), а за рахунок зіткнення іонів утворюються молекули (молізація).
Кількісну характеристику рівноважного складу дисоціації електроліту дає ступінь його дисоціації α, що вказує, яка частка молекул розпалась на іони :
(число молекул, що розпались)
α = ---------------------------------------- .
(загальне число молекул)
Коефіцієнт і для неелектролітів дорівнює одиниці, а для електролітів більший за одиницю. Величина його з розбавленням розчину буде збільшуватись, наближаючись до граничного значення для кожного електроліту: до простого цілого числа 2, 3, 4 - в залежності від числа іонів, що утворюються при розчиненні молекули речовини. Наприклад, при розчиненні речовин:
NaCl ↔ Na+ + Cl- i → 2 ;
K2SO4 ↔ 2K+ + SO4- i → 3 ;
3.2 Електроліти, в організмі людини.
Електроліти відіграють колосальну роль у життєдіяльності організмів, зокрема людського організму. Якщо відвернутися від біохімічних і фізіологічних функцій кожного окремо катіона й аніона і зупинитися лише на їхній спільній дії, то потрібно відзначити, що наявністю електролітів, в основному, визначається величина осмотичного тиску фізіологічних рідин Існуванням перепадів осмотичного тиску (осмотичних градієнтів) пояснюються явища активного транспорту води, що відбуваються в живому організмі за допомогою осмосу. Наявність електролітів у фізіологічних рідинах помітно впливає на розчинність білків, амінокислот і інших органічних сполук, особливо низькомолекулярних з полярним характером молекул При невеликих концентраціях, коли іонна сила розчину I < 1-2, збільшення вмісту в рідинах електролітів приводить, наприклад, до підвищення розчинності в них гемоглобіну, карбоксигемоглобіну і цистіну. Однак подальше збільшення концентрації електролітів (I> 2) приводить до зниження розчинності цих речовин. Здатність електролітів утримувати воду у вигляді гідратів перешкоджає зневоднюванню організму.
При нормальному стані організму вміст катіонів у плазмі крові складає в середньому 154 моль/м3 і приходиться, в основному, на частку іонів натрію, калію, кальцію і магнію. Серед аніонів, загальний вміст яких у плазмі крові складає теж -154 моль/м3, велика частка приходиться на хлорид- і гідро-карбонат-іони, а також багатозарядні макроіони білків. По вмісту окремих катіонів і аніонів у плазмі крові близька проміжна (інтерстиціальна) рідина. Обидві ці позаклітинні рідини істотно відрізняються за складом від внутрішньоклітинних рідин (табл.).
Таблиця :

Важливо відзначити, що зневоднювання організму при недоліку в ньому електролітів не може бути повною мірою усунуто тільки посиленим споживанням води. Дефіцит електролітів і зв'язана з цим втрата організмом води приводять насамперед до згущення крові, що несприятливо позначається на всій динаміці кровообігу.
Загальний вміст води в організмі людини в розрахунку на середню масу 70 кг складає 42 кг, або 60 % від усієї маси. Причому 2/3 цієї кількості зосереджено у внутрішньоклітинних рідинах (еритроцитах, клітках м'язової тканини і т.д.), а 1/3 - у позаклітинних (плазмі крові, тканинної рідини, лімфі тощо). У плазмі крові знаходиться -3,5 кг води, а в інтерстиціальній рідині ~ 10,5 кг (5 і 15 %, відповідно від маси тіла).
Втрата приблизно 1/3 усієї кількості води, що знаходиться в позаклітинних рідинах, небезпечна, а втрата 2/3 вже є смертельною. Тому порушення нормального електролітного балансу організму викликає серйозні наслідки. Необхідно, щоб постійні втрати електролітів через шлунково-кишковий тракт, нирки і за рахунок потовиділення безупинно поповнювалися з їжею і питною водою. Про значення електролітів для життєдіяльності організму людини і тварин свідчать досвіди, у яких демонструється можливість тривалого (годинами) функціонування ізольованих органів тварин. Наприклад, серце жаби або кролика в розчині, що містить ту ж концентрацію електролітів, що і у плазмі крові, функціонує досить довго. У чистій воді або в розчинах з більш низькою концентрацією іонів їхня діяльність припиняється майже миттєво.
Порушення обміну катіонів в організмі приводить до адінамії- м'язової слабкості, до припинення або різкого ослаблення рухової активності Серед катіонів, за винятком Н+, найбільше значення мають Na+ і К+, які виявляються практично у всіх тканинах.
Натрій є в основному позаклітинним катіоном: його вміст у плазмі крові (130-155 моль/м3) значно вище, ніж у нерозділеній крові (79-91 моль/м3), у якій містяться ще форменні елементи (еритроцити, лейкоцити і кров'яні пластинки) із клітинною структурою.
Калій, навпаки, є типовим внутрішньоклітинним катіоном: його вміст у цільній крові досягає 40-60 моль/м3, а в плазмі - 4,0-5,6 моль/м3.
Загальна маса іонів натрію в організмі дорослої людини -0,15 кг, причому для забезпечення нормального обміну речовин необхідно споживати щодоби з їжею 0,010-0,015 кг кухонної солі (при безсольовій дієті не менш 0,002 кг). Недолік в організмі іонів натрію викликає негативні наслідки: падіння осмотичного тиску (гіпоосмія) у позаклітинних рідинах і зв'язане з цим проникнення води усередину еритроцитів, клітини головного мозку й ін., що призводить до гемолізу й інших форм цитолізу, а також до згущення крові. Внаслідок цього спостерігаємо підвищення в'язкості крові, падіння артеріального тиску, порушення нормальної серцевої діяльності. (тахікардія), спазм гладкої мускулатури, набряк головного мозку, розлад центральної нервової системи. Нагромадження в організмі надлишкової кількості кислот (ацидоз) через виснаження так званого лужного резерву, створюваного в організмі, головним чином, солями натрію, може призводити до гальмування розвитку і росту організму, особливо молодого.
Досить небезпечні розлади викликані появою в організмі надлишку катіонів натрію. Якщо надлишок іонів натрію значний, то в міжклітинний простір, де він в основному накопичується, підсилюється приплив води, розвиваються набряки, одночасно порушуються і функції клітин, що втратили частину води, і вони поступово відмирають. Крім того, відбувається гальмування в передачі нервових імпульсів, розвивається надлишковий артеріальний тиск (гіпертонія).
Загальний вміст іонів калію в організмі дорослої людини звичайно знаходиться на рівні 0,133-0,140 кг, добова потреба в ньому складає 0,002- 0,003 кг. Іони калію беруть участь у передачі нервових імпульсів, у здійсненні м'язових скорочень і в регулюванні діяльності серця (сповільнюють ритм і зменшують силу скорочень серцевого м'яза).
Недолік в організмі калію (гіпокаліємія) може виникнути при тривалих і сильних проносах, блювоті, надлишковому сечовиділенні (через уживання сечогінних засобів; при введенні в організм великих кількостей розчинів, що не містять іонів калію; при порушенні функцій кори надниркової залози тощо). При цьому спостерігається придушення нервово-м'язової збудливості, гальмується синтез білка і підсилюється його розпад. Усе це призводить до м'язової слабкості, стомлюваності, задишці, нудоті, порушенню нормальної діяльності серця, підвищенню тиску крові у венах, зникненню рефлексів, розвитку паралічів і галюцинацій. Значний надлишок в організмі іонів калію викликає хвороби нирок, підсилює розпад еритроцитів (гемоліз) і тканинних клітин, порушення кислотно-лужної рівноваги, спостерігаються також специфічні розлади серцевої діяльності.
Вміст іонів кальцію в організмі дорослої людини складає -1,050 кг, 99 % цієї кількості знаходиться в складі кісток у вигляді важко розчинних фосфатів, головним чином у виді трикальційфосфату Сa3(РО4)2. При недостатнім надходженні в організм кальцію (менш 0,007 кг/добу), особливо у дитячому віці, утворювана хрящеподібна тканина не костеніє, розвивається рахіт з такими загальновідомими наслідками, як скривлення кісток ніг, грудної клітки (куряча хвороба), хребта і таза (рахітичний горб і таз), розм'якшення кісток (остеомаляція) і т.д.
У нерозділеній крові утримується —12 моль/м3 іонів кальцію, а в плазмі крові 4,5-5,7 моль/м3, однак роль цих іонів у забезпеченні нормальної діяльності нервової, м'язової і серцево-судинної систем надзвичайно велика.
Взаємний вплив катіонів кальцію, що знаходяться у крові, і калію є одним з найбільш характерних прикладів прояву антагонізму іонів. Якщо іони калію флегматизують скорочення серцевого м'яза, то їхні антагоністи - іони кальцію, збільшують ритм і силу серцевих скорочень. При недоліку в плазмі крові іонів кальцію різко підсилюється збудливість нервової і м'язової систем, порушується нормальне функціонування клітинних ферментів, з'являються судороги, припадки, приступи заціпеніння (тетанія). Якщо вміст іонів кальцію в крові падає нижче 2,5 моль/м3, це може призвести до втрати свідомості і смерті.
Важливу роль відіграють іони кальцію в процесах згортання крові Якщо до крові додати 4 %-ний розчин лімонно-кислого натрію, то іони кальцію майже націло осаджуються у вигляді малорозчинного тетрагідрату Цитрату кальцію Са3(С6Н5О7)3.4Н2О. Кров втрачає здатність до згортання. У такому вигляді "нітратну кров" звичайно і використовують при переливанні крові.
До неприємних наслідків призводить і надлишок іонів кальцію в плазмі крові (гіперкальціємія), при якій може виникнути гіпокаліємія, підвищене відкладення в організмі кальцієвих солей (ниркові камені, скам'яніння плоду у вагітних, міжтканеві опади тощо).
Загальний вміст іонів магнію в організмі дорослої людини складає в середньому 0,028 кг, причому приблизно 0,009 кг знаходяться в складі внутрішньоклітинних і позаклітинних рідин. Добова потреба людини в магнії -0,0007 кг. Основна роль магнію зводиться до стимулювання активності ферментів вуглеводного обміну, а також до зниження збудливості центральної нервової системи. При підвищеному вмісті у крові іонів магнію спостерігаються сонливість, утрата чутливості, параліч кістякових м'язів; при значному збільшенні концентрації іонів магнію (>9 моль/м3) може наступити глибокий наркоз.
Магній активно впливає на обмін в організмі калію і кальцію, при його недоліку розвивається гіперкаліємія і зв'язане з цим посилення нервово-м'язової збудливості. Споживання надмірних кількостей з'єднань магнію приводить до поступового витіснення кальцію з кісткової тканини, а дефіцит його в крові - до відкладення важкорозчинних солей кальцію в нирках, м'язах, серці і стінках артерій.
У набагато менших концентраціях, ніж іони натрію, калію, кальцію і магнію, у складі рідин людського організму присутні іони ~50 інших елементів, велика частина яких знаходиться у формі комплексних іонів складної будови. Навіть і при таких невеликих концентраціях багато з цих іонів відіграють значну роль у процесах обміну речовин і енергії які безперервно відбуваються в організмі.
3.3 Ступінь та константа дисоціації слабких електролітів.
Вивчаючи поведінку розчинів слабких електролітів (таких як СН3СООН, NН4ОН, С6Н5ОН, НСN, Н2О та інших) Оствальд (1888) помітив, що чим менша концентрація розчину (або чим більше розведення), тим стає більша ступінь дисоціації розчиненої речовини. Пояснення цього явища ним було дано на основі електролітичної дисоціації у вигляді закони розведення.
Розглянемо на прикладі :
СН3СООН + Н2О ↔ СН3СОО- + Н3О+
На основі закону діючих мас :
[СН3СОО-] . [Н3О+]
Кдис = --------------------------
[СН3СООН]
Величина Кдис називається термодинамічною константою дисоціації або скорочено константою дисоціації.
Виразимо загальну концентрацію електроліта в моль/л через с, а ступінь дисоціації позначимо через α. Тоді концентрація недисоційованої кислоти буде дорівнювати:
[СН3СООН] = с ( 1 – α )
а концентрація продисоційованих іонів :
[СН3СОО-] = сα ; [Н3О+] = сα ;
підставивши, одержуємо закон розбавлення :
α2
Кдис = -------------- . с ;
( 1 - α)
Визначення ступеня дисоціації електроліту а.
λν
Обчислюється за формулою α = --------, в якій λν - еквівалентна елек-
λ∞
тропровідність розчину при певному розведенні; λ∞ - гранична електропровідність. Еквівалентну електропровідність λν легко визначити експериментальне, а гранична електропровідність λ∞ при нескінченному розведенні розраховується за таблицями (згідно з законом Кольрауша).
Визначення константи дисоціації слабких електролітів.
За законом розбавлення Оствальда:
α2
Кдис = -------------- . с ;
( 1 - α)
Підставивши в це рівняння значення α получаємо :
α2 λν2 . с
Кдис = -------------- . с = ----------------- ;
( 1 - α) λ∞( λ∞ - λν)
Останнє рівняння безпосередньо зв'язує константу дисоціації Кдис з електропровідністю λν при певному значенні концентрації с. Вимірюючи експериментальне електропровідність λν при певних значеннях с, а також розраховуючи величину λ∞ знаходять константу дисоціації.
3.4 Властивості розчинів сильних електролітів.
Теорія розчинів сильних електролітів. С. Арреніус вважав, що і в розчинах сильних електролітів відбувається оборотна дисоціація на іони, оскільки знайдені досвідченим шляхом значення електричної провідності, ізотонічного коефіцієнта, ступеня дисоціації, колігативні властивостей для сильних електролітів виявляється менше, ніж слід було б чекати при 1ОО % - вій дисоціації.
Проте таке трактування Ареніуса виявилося помилковим.
Практично повна дисоціація сильних електролітів на іони незалежно від концентрації їх розчинів підтверджується фізичними і фізико-хімічними методами дослідження. Так, значення теплоти нейтралізації всіх сильних кислот сильними підставами в розбавлених розчинах практично однакові. Незалежно від природи кислоти і підстави набувають однакового значення ΔН= - 56,5 кдж/моль. Цей факт - наочний доказ повної дисоціації розбавлених розчинів кислот і основ. У всіх випадках загальним протікаючим при нейтралізації процесом є з'єднання іонів Н3О+ і ОН- в молекулі води :
Н3О+ + ОН- = 2Н2О ; ∆Н = - 56,5 кДж/моль.
Інший доказ повної дисоціації сильних електролітів на іони дає рентгеноструктурне дослідження кристалів сильних електролітів типа КС1, яке показало, що ці речовини навіть в твердому вигляді складаються не з молекул, а з позитивно і негативно заряджених іонів, розташованих у вузлах кристалічної решітки. Крім того, дослідження концентрованих розчинів сильних електролітів оптичними методами показало відсутність молекул в цих розчинах. Суперечність, що здається, пояснюється в теорії Дебая і Хюккеля електростатичною міжіоною взаємодією в розчинах.
У водних розчинах сильні електроліти практично повністю дисоційовані. І на відміну від розчинів слабких електролітів їх розчини містять значно більше число іонів. У не дуже розбавлених розчинах відстань між іонами мало. Це приводить до сильної міжіоною взаємодії. В результаті біля кожного іона знаходяться переважно іони протилежного знаку: утворюються іонні пари:

Кt+Аn-, триплети Кt+Аn- Кt+ або Аn- Кt+Аn- і «іонні атмосфери» (мал. 3.2). Як наслідок, виникає ефект зменшення числа іонів, що беруть участь в хімічних процесах.
При русі іонів під дією електричного поля іон даного знаку рухається до протилежно зарядженого електроду, а що оточує його «іонна атмосфера» гальмує рух і зменшує рухливість іона (мал. 3.3). Чим більше концентрація розчину, тим сильніше виявляється гальмуюча дія «іонної атмосфери». Крім того, рух іонів гальмується також сольватними оболонками. При розбавленні розчину вплив «іонної атмосфери» зменшується, а при нескінченному розведенні зникає, оскільки іони практично не взаємодіють між собою.
В результаті гальмуючої дії «іонних атмосфер» (міжіоні взаємодії) знижується ефективність іонів в таких явищах, як перенесення заряду (електричний струм) в розчинах, пониження температури замерзання, підвищення температури кипіння. Саме тому визначувана, наприклад, по електричній провідності розчинів ступінь дисоціації сильних електролітів є ступенем дисоціації, що здається, оскільки вона не відповідає дійсному ступеню розпаду електроліту на іони.
З меншення
цієї величини із зростанням концентрації
розчину пояснюється не рекомбінацією
іонів з утворенням молекул, а збільшенням
міжіоних взаємодій і утворенням іонних
пар Кt+Аn-,
триплети Кt+Аn-
Кt+
або Аn-
Кt+Аn-
і інших іонних асоціатів,
внаслідок цього збільшується гальмуюча
дія «іонних атмосфер», ослабляється
дія електричного поля на частинки.
меншення
цієї величини із зростанням концентрації
розчину пояснюється не рекомбінацією
іонів з утворенням молекул, а збільшенням
міжіоних взаємодій і утворенням іонних
пар Кt+Аn-,
триплети Кt+Аn-
Кt+
або Аn-
Кt+Аn-
і інших іонних асоціатів,
внаслідок цього збільшується гальмуюча
дія «іонних атмосфер», ослабляється
дія електричного поля на частинки.
Таким чином, можна вважати, що у всіх процесах в розчинах електролітів беруть участь лише «активні іони», тобто іони, що не беруть участі в даний момент в міжіоних взаємодіях. У зв'язку з цим для оцінки концентраційних ефектів в розчинах сильних електролітів вводиться величина, звана активністю α :
під активністю електроліту X розуміють ефективну концентрацію відповідно до якої він бере участь в різних процесах.
3.5 Активність та коефіцієнт активності. Йона сила розчину.
Водно-електролітний баланс - необхідна умова гомеостазу.
Активність пов'язана з дійсною концентрацією розчиненої речовини співвідношенням
α (Х) = f (X) . c (X)
де α(X) - активність електроліту, моль/л; с(Х) -его концентрація, моль/л; f(X) - коефіцієнт активності (величина безрозмірна).
Коефіцієнт активності f(X) виражає відхилення розчину концентрацією с(Х) від поведінки розчину при нескінченному розведенні, т. т. у відсутності міжіоних взаємодій.
Експериментальні значення активності і коефіцієнта активності електроліту можна визначити, наприклад, кріометричним, осмометричним, електрохімічним методами. Відповідно в різних формулах для рівноваг замість концентрацій повинна фігурувати активність.
Іонна сила розчину. У розбавлених розчинах природа іонів трохи впливає на значення коефіцієнтів активності, оскільки міжіоні взаємодії визначаються тільки зарядами іонів і їх концентрацією. При цьому кількісною характеристикою міжіоних електростатичних взаємодій є іонна сила розчину I :
іонною силою розчину називають величину, вимірювану напівсумою творів концентрацій всіх іонів, що знаходяться в розчині, на квадрат їх заряду.
Для характеристики залежності активності іонів від концентрації всіх іонів, що входять до складу електроліту, було введено поняття "іонна сила розчину".
Як показали Г.Льюіс і М.Рендал (1921), коефіцієнт активності у розведених розчинах сильних електролітів має одну і ту ж величину, якщо ці розчини мають однакову іонну силу. Коефіцієнт активності даного електроліту у розчині залежить тільки від іонної сили розчину, і в розведених розчинах при однаковому значенні іонної сили коефіцієнт активності зберігає стале значення незалежно від природи інших електролітів, що присутні в розчині.
Величина іонної сили I визначається як напівсума добутків концентрацій іонів с на квадрати величин їх зарядів z :
I = 0,5 Σ cizi2
де с - концентрація іона (в моль-екв/м3), z – заряд іона.
Якщо в розчині містяться тільки однозарядні іони, то іонна сила чисельно дорівнює загальному мольному вмісту їх в розчині.
Для біохімічних і біологічних досліджень визначення іонної сили розчину досить важливо. Так, наприклад, для досягнення великої точності досвідів і спостережень за дією деяких розчинів на організм тварин і людини дуже важливо приготувати ці розчини однієї і тієї ж іонної сили.
Ряд сильних електролітів (NаСІ, КС1, СаС12, МgС12 і ін.) є основним компонентом крові і лімфи органів і тканин тварин, а також зовнішніх середовищ, у яких живуть водні організми. Іонна сила крові тварин приблизно дорівнює 0,15.
Роль електролітів в процесах життєдіяльності. Біологічні рідини і тканини містять багато різних електролітів: NaС1, КС1, НС1, СаС12,NаН2РО4, NaНСО3 і ін. Стійкість біологічних ВМС і швидкість багатьох біохімічних реакцій значною мірою залежать від природи і концентрації присутніх в рідинах і тканинах іонів. Поведінка іонів в складних біологічних системах, якими є живі організми, визначається викладеними закономірностями. Організм людини постійно втрачає воду: частково з потім, частково через легені, але в основному шляхом виділення сечі. При цьому з сечею і потім втрачається значна кількість електролітів (в основному, неорганічних солей). Концентрація іонів в тканинах підтримується приблизно постійною (іонний гомеостаз). Тому прийом і виділення солей тісно пов'язані з обміном води.
При тривалій спразі об'єм позаклітинного простору тканин зменшується за рахунок зменшення кількості води. Це приводить до збільшення концентрації іонів. Для компенсації підвищення осмотичного тиску з сечею віддаляються іони Na+ і С1- Якщо і надалі вода не поступає в організм, в сечі з'являються іони К+. Це указує на скорочення і внутріклітинного простору, унаслідок чого клітки віддають. свої іони. Паралельно зменшується об'єм плазми крові, концентрація електролітів підвищується, і відбувається «згущування» крові.
Якщо в результаті якихось захворювань відбувається виділення сечі з підвищеним вмістом солей, то разом з сіллю організм втрачає і воду. При цьому зменшується концентрація іонів в плазмі крові, що призводить до зниження осмотичного тиску крові.
Процеси ресорбції (зворотне всмоктування) води і іонів (Nа+, К+, С1-) незалежні. Тому зрушення концентрацій, виникаюча в результаті непостійність співвідношення введеної кількості води і солей, усуваються нирками шляхом зміни ресорбції відповідних іонів або води.
При недоліку солей в організмі об'єм позаклітинного простору також зменшується, оскільки організм не в змозі заповнити його ізотонічним розчином. Тому для підтримки постійності осмотичного тиску в позаклітинному просторі втрата солей супроводжується виведенням води.
Таким чином, концентрація іонів регулює розподіл води між позаклітинним простором і клітинами тканин, а також між позаклітинним простором і сечею.
Кислотно-лужна рівновага в крові і біорідинах визначається змістом слабких і сильних електролітів: Na2НРО4, NаН2РО4, Н2СО3, NаНСО3 і ін. Для розуміння механізму дії цих речовин необхідне знання їх констант дисоціації.
Іони грають визначальну роль в створенні осмотичного тиску різних біологічних рідин. Особливості метаболічного обміну іонів мають велике значення для життєдіяльності організмів. Так, наприклад, обмін іонів К+ важливий для роботи нервових і м'язових клітин. Надходження іонів К+ при нормальному живленні відбувається постійно. Але, оскільки іони К+ віддаляються нирками, рівень концентрації іонів К+ в плазмі не підвищується, поки нирки працюють нормально. Зменшення концентрації іонів К+ усередині кліток може привести до захворювання, відомого під назвою періодичного паралічу. Суть захворювання полягає в періодичній появі паралічів унаслідок зниження рівня іонів К+ в крові і, отже, в клітках. При відновленні нормального змісту іонів К+ в крові параліч проходить.
Самостійна робота: Сильні та слабкі електроліти
У водних розчинах деякі електроліти повністю розпадаються на іони. Інші електроліти розпадаються на іони частково. Велика частина їх молекул залишається в розчині в недисоційованому вигляді. У розчинах таких електролітів одночасно присутні і іони і недисоційовані молекули розчиненої речовини. Для кількісної характеристики співвідношення дисоційованих і недиссоційованих молекул електроліту використовують поняття «Ступінь електролітичної дисоціації».
Для кожного електроліту ступінь електролітичної дисоціації визначають досвідченим шляхом, вимірюючи електропровідність його водного розчину.
Ступінь дисоціації позначають буквою «α» і часто виражають у відсотках, рідше в долях одиниці. Ступінь електролітичної дисоціації рівний відношенню числа молекул, які розпалися на іони, до загального числа розчинених молекул електроліту:
n n
α = ---- . 100% или α = ---- ,
N N
де n - число молекул, що розпалися на іони; N - загальне число розчинених молекул.
Наприклад, ступінь дисоціації (α) оцтової кислоти СН3СООН в 0,1 М розчині рівна 1,36 %. Це означає, що з 10000 молекул СН3СООН 136 розпадаються на іони по рівнянню: СН3СООН ↔СН3СОО- + Н+
Ступінь дисоціації залежить від природи розчинника і природи розчиненої речовини.
Одна і та ж речовина в одних розчинниках може поводитися як електроліт, в інших - як неелектроліт. Наприклад, молекули сірчаної кислоти Н2SО4 добре дисоціюють у воді, слабкіше в етанолі і зовсім не дисоціюють в бензолі. Це пояснюється тим, що вода є одним з найбільш полярних розчинників, етанол - слабкополярний, а бензол - неполярний розчинник.
Оскільки на практиці як розчинник найчастіше використовується вода, розглянемо класифікацію електролітів по ступеню дисоціації у водних розчинах.
На ступінь іонізації впливає тип хімічного зв'язку в молекулах електроліту. Електроліти, що відрізняються один від одного типом хімічного зв'язку, дисоціюють у водному розчині різною мірою. Так, для електролітів з іонними або сильно полярними ковалентними зв'язками дисоціація протікає у вода практично без остачі. Ці електроліти називають сильними.
Таким чином, сильні електроліти - це такі електроліти, для яких ступінь дисоціації у водних розчинах рівний 1 (100%). До сильних електролітів відносяться:
1. Практично всі солі;
2. Кислоти - НС1О4, НСlO3, НNO3, Н2SО4, НМnО4, Н2Сг2O7, HI, НВг, НС1, Н2СгO4;
3. Луги - LiOH, NаОН, КОН, СaОН, RbОН, Са(ОН)2, Sr(ОН)2, Ва(ОН)2.
Кислоти і основи, що є сильними електролітами, відносяться до сильних кислот і сильних основ.
Електроліти із слабо полярними зв'язками дисоціюють у воді частково. Ступінь іонізації залежить від ступеня полярності зв'язків в їх молекулах. Електроліти, які дисоціюють не повністю, називають слабкими.
Отже, слабкі електроліти - це такі електроліти, для яких ступінь дисоціації у водних розчинах менше 1 (100%).
До слабких електролітів відносяться:
Слабкі кислоти - НС1О2, НСlO, НNО2, Н2СО3, Н2SO3, Н3РО4, HF, Н3ВО3; СН3СООН, Н2S, НСN і ін.;
Слабкі малорозчинні у воді основи і амфотерніі гідроксиди: Fе(ОН)2, Fе(ОН)3, Сu(ОН)2, Рb(ОН)2, А1(ОН)3, Сг(ОН) 3;
Вода Н2O.
NH4ОН.
Не слід плутати розчинність речовини з його належністю до сильних і слабких електролітів. Наприклад, хлорид срібла АgС1 має дуже низьку розчинність у воді. Проте вся сіль, що розчинилася, знаходиться в розчині у вигляді іонів Аg+ і С1-, тому АgС1 відносять до сильних електролітів.
З іншого боку, наприклад, газ аміак NH3 дуже добре розчиняється у воді, але тільки частина молекул NН3 взаємодіє з водою з утворенням іонів NН4+ і ОН-. Означає гідроксид амонія є слабким електролітом.
На ступінь дисоціації слабких електролітів впливає декілька чинників.
Ступінь іонізації електроліту залежить від його концентрації в розчині. Розбавлення розчину веде до підвищення ступеня дисоціації електроліту. Це відбувається тому, що із зменшенням його концентрації зменшується вірогідність зустрічі іонів в розчині.
Підвищення концентрації електроліту в розчині знижує ступінь його іонізації.
Чим слабкіше електроліт, тим більше підвищується його ступінь дисоціації у міру розбавлення розчину.
Зміна температури розчину електроліту також впливає на ступінь іонізації.
При підвищенні температури ступінь дисоціації електроліту збільшується. Це пояснюється тим, що з підвищенням температури енергія молекул збільшується, хімічний зв'язок в них ослабляється, що полегшує процес дисоціації електролітів, тобто їх розпад на іони. І навпаки, пониження температури зменшує ступінь іонізації електроліту.
На ступінь дисоціації впливає додавання однойменних іонів до розчину слабкого електроліту.
Наприклад, якщо до розчину оцтової кислоти СН3СООН підлити розчин ацетату натрію СН3СООNа, тобто збільшити концентрацію ацетат- іонів СН3СОО-, то рівновага оборотного процесу дисоціації оцтової кислоти СН3СООН ↔СН3СОО- + Н+ згідно принципу Ле-Шателье зміщується вліво. Тому ступінь дисоціації оцтової кислоти зменшується.
Біонеоганічна хімія
Лекція № 4 . Водневий показник. Гідроліз солей
4.1 Дисоціація води. Йонний добуток води.
4.2 Водневий показник рН. Значення рН для різних рідин людського
організму в нормі та патології.
4.3 Теорії кислот та основ.
4.4 Типи протолітичних реакцій: нейтралізації, гідролізу та йонізації.
Гідроліз солей. Роль гідролізу в біохімічних процесах.
Самостійна робота: Окисно – відновні реакції
4.1 Дисоціація води. Йонний добуток води.
Вода дисоціює на іони, хоча і дуже в слабкій мірі, згідно рівняння:
Н2О ↔ Н+ + ОН- ( 1 )
Термодинамічна константа дисоціації води Кв відповідає рівнянню (1) реакції електролітичної дисоціації за теорією Арреніуса:
[Н+ ] [ОН-]
Кв = ---------------
[Н2О]
Оскільки при дисоціації утворюється однакове число іонів Н+ і ОН-, то концентрація кожного з них у воді при 298 К буде дорівнювати:
10-14 -----------
[Н+ ] = --------------- , √ 10-14 = 10-7 моль/литр
[ОН-]
Величина іонного добутку залишається постійною при незмінній температурі не тільки у воді, але й у будь-якому водному розчині кислот, лугів і солей. Зв'язані між собою іонним добутком [Н+][ОН-] = 10-14, концентрація гідроксид-іонів і гідрогену є величинами сполученими. Отже, якщо додаванням кислоти збільшують концентрацію іонів гідрогену, то одночасно в стільки ж разів зменшується концентрація гідроксид-іонів.
У результаті добуток концентрацій іонів не змінюється Внаслідок сталості іонного добутку води концентрацію одного з іонів обчислюють за відомою концентрацією іншого:
10-14
[Н+ ] = ---------------
[ОН-]
10-14
[ОН- ] = ---------------
[Н+]
Кожне з цих рівнянь показує, що збільшення концентрації одного з іонів неминуче зв'язано з таким же зменшенням концентрації іншого. Таким чином, у будь-якому водному розчині одночасно присутні як іони гідрогену, так і гідроксид-іони, і іонний добуток їх Кв залишається постійним при 298 К рівним 10-14.
Концентрація [Н+], з якою приходиться мати справу на практиці, звичайно виражається малими величинами. Наприклад, сама кисла рідина організму людини - шлунковий сік - має концентрацію [Н+] біля 10-1 моль-екв/м3, а концентрація [Н+] у слині - біля 10-6 моль-екв/м3 і т.д.
4.2 Водневий показник рН. Значення рН для різних рідин
людського організму в нормі та патології.
Для зручності реакцію розчину за пропозицією В.Соренсена (1920) характеризують не концентрацією іонів гідрогену, а десятковим логарифмом їх концентрації зі зворотним знаком. Ця величина називається водневим показником і позначається символом рН
рН = -lg[H+]
тобто водневий показник - це від'ємний логарифм концентрації іонів гідрогену.
Для чистої води при 298 К рН = -lg[10-7] = 7 . Для кислих рідин рН < 1 , для лужних - рН > 1 .
Заміняючи концентрацію іонів гідрогену через водневий показник, можемо виразити єдиною шкалою реакцію середовища всіх градацій розчинів: від сильнокислих через нейтральні і до сильнолужних рН:
[Н+] моль/л 100 10-1 10-2 10-3 10-4 10-5 10-6 10-7 10-8 10-9 10-10 10-11 10-12 10-13 10-14
↓



 рН 0 1 2 3 4 5 6
7 8 9 10 11 12 13 14
рН 0 1 2 3 4 5 6
7 8 9 10 11 12 13 14
 сильнокисла слабокисла
слаболужна сильнолужна
сильнокисла слабокисла
слаболужна сильнолужна
нейтральна
У біологічних процесах іони гідрогену займають особливе положення серед інших іонів. Так, активність ферментів, за допомогою яких здійснюється синтез і розкладання хімічних речовин у живій клітині, безпосередньо залежить від концентрації іонів гідрогену. Кожний фермент має визначену величину рН, оптимальну для його дії.
Концентрація іонів гідрогену має велике значення в життєдіяльності мікроорганізмів. Установлено, наприклад, що дифтерійний мікроб краще розвивається при рН у межах 7,3-7,6, мікроб кишкової палички при рН 6-7. У прямій залежності від рН знаходиться діяльність ґрунтових мікроорганізмів. Наприклад, активна фіксація азоту мікробами спостерігається при рН = 7,2. Відношення вищих рослин до рН грунту також різне. Так, наприклад, овес, ріпа, картопля, жито дають найвищі врожаї при рН близько 5; пшениця, ячмінь, буряк, люцерна краще розвиваються при нейтральній реакції грунту або навіть при слаболужному.
По видовому складу лугової рослинності можна визначити рН ґрунту. Наприклад, присутність рослини щучки (Dеsсhат-ріsіа flехиоsа) вказує на рН ґрунту 3,5-3,9; переважна наявність осоки (Саrех) на рН у межах 4,5— 4,9; велика кількість матері-і-мачухи (Tussilago farfara) - на рН 7,5-7,9 і т.д.
Штучно змінюючи рН середовища, наприклад внесенням у грунт вапна або суперфосфату, можна регулювати і змінювати бактеріальне населення фунту, сприяти її нітрифікації і т.д. Величезний вплив концентрація іонів гідрогену має на функціональну діяльність окремих органів і тканин вищих тварин і людини.
Концентрація іонів гідрогену впливає на основні фізико-хімічні властивості речовин і розчинів: розчинність, фільтрацію, діаліз, поверхневий натяг, в'язкість, стійкість, осмотичний тиск, набрякання і т.д. От чому визначення концентрації іонів гідрогену знайшло застосування у всіх областях хімії, біології, фізіології, бактеріології, медицини, сільського господарства і техніки.
В живих організмах співвідношення між концентрацією [Н+] і [ОН- ] іонів в тканинних рідинах, крові і інших (так звана кислотно-основна рівновага) найчастіше виражають через водневий показник рН. Кислотно-основна рівновага або кислотно-основний стан (КОС) - один з головних факторів гомеостазу. Він спрямований на підтримання постійності концентрації іонів гідрогену (або рН середовища). Стан кислотно-основної рівноваги впливає на напрямок і швидкість хімічних реакцій. Особливо великий вплив рН середовища має на перебіг ферментативних реакцій. Підтримка сталого значення кислотно-основної рівноваги визначає нормальний перебіг всіх процесів життєдіяльності.
Значна частина тканин організму здорової людини має слаболужну реакцію. В тканинних рідинах рН підтримується на рівні 7,1-7,4. Лише деякі рідини мають більш лужне середовище, наприклад секрет товстого кишечнику має рН = 8. Шлунковий сік має дуже кисле середовище: рН від 0,9 до 1,5 (дивись таблицю):

Виключно велику роль має підтримка сталої величини рН середовища у крові. Під час процесів метаболізму або з їжею у кров безперервно проникають різні речовини, які є джерелами кислот або основ, але величина рН в ній залишається на сталому рівні. Це відбувається завдяки різним фізіологічним механізмам, які сприяють видаленню кислот і основ з організму, а також завдяки наявності буферних систем.
4.3 Теорії кислот та основ.
З самого початку уявлення про кислоти і основи базувались суто на експериментальних даних. Було виявлено, що ряд рідин має загальні властивості - здатність розчиняти мінерали (наприклад, вапняк) і метали, змінювати забарвлення деяких органічних барвникіа До таких рідин належав і оцет (кислий за смаком), тому і увесь клас подібних до нього речовин одержав назву кислоти.
Було також знайдено, що інша група речовин виявляє властивості, протилежні кислотним. Ці речовини розчиняли мастила, змінювали забарвлення органічних барвників, надаючи їм колір, відмінний від кольору у кислому середовищі. Але найважливішою властивістю речовин цієї групи була їх здатність нейтралізовувати дію кислот. Спочатку ці речовини називали лугами. Але пізніше подібні властивості були виявлені і у великого класу сполук, відомих як основи.
Перші спроби знайти причину їх загальних властивостей належить Лавуазьє( 1743-1794).
Можливість нового підходу до тлумачення про кислоти і основи стала реальністю після того, як Сванте Арреніусом була розроблена теорія електролітичної дисоціації. Уявлення про іонізацію речовин в розчинах дали можливість створити моделі кислот і основ, які пояснюють загальні властивості цих груп речовин на основі узагальнення їх будови і поведінки при розчиненні в рідинах.
Згідно Арреніусу до класу кислот належать гідрогенвмісні сполуки, здатні у водних розчинах дисоціювати з утворенням іонів гідрогену. Клас основ визначається як група речовин, що утворюють при дисоціації у водних розчинах гідроксид-іони. Було прийнято вважати іон гідрогену носієм кислотних, а гідроксид-іон — носієм основних властивостей. Ці уявлення у певній мірі відповідають сучасним поглядам на кислоти і основи.
На основі теорії електролітичної дисоціації була створена узагальнена теорія кислот і основ, яка давала пояснення явищам нейтралізації, гідролізу, буферної дії, дисоціації води, рН розчинів та іншого з загальних позицій.
Недосконалість теорії Арреніуса знаходить своє відображення в трактовці кислот і основ. Висновки цієї теорії виявилися непридатними до сильних кислот і основ. Крім того, було виявлено, що кислотно-основна взаємодія не обмежується тільки водними розчинами. Аналогічні процеси були виявлені у рідкому аміаці, органічних розчинниках, рідкому диоксиді сульфуру тощо. Ці явища не піддаються опису з точки зору теорії Арреніуса, тому виникла необхідність створення теорій, які б дали можливість пояснити властивості кислот і основ з урахуванням нових досягнень в дослідженнях розчинів.
Серед нових теорій наукове і практичне значення набули протонна теорія Бренстеда-Лоурі, донорно-акцепторна теорія Льюїса і теорія сольвосистем.
Згідно теорії Бренстеда-Лоурі кислотами є речовини, які прагнуть віддати протон, а основами -речовини, які прагнуть приєднати протон.
В загальному випадку взаємозв'язок між кислотою і основою прото-літичної пари описуються схемою
А ↔ В- + Н+
кислота основа протон
Згідно цієї рівноваги, основою може бути будь-яка речовина, що здатна приєднати протон. Гідроксид-іон виступає у якості основи. Але до основ можна також віднести
молекули і іони, що не містять гідроксильних груп (NН3, НСО3-, СО32-, РO42-, СН3СОO- тощо).
Рівновага дисоціації кислоти визначається силою спряженої з нею основи (аніону):
СН3СОOH ↔ СН3СОO- + H+
Чим міцніша основа, тим більш міцно зв'язується протон і, як наслідок, утворюється менш дисоційована кислота. Тому для водних розчинів поняття сили кислоти співпадає з тим поняттям, яке випливає з теорії Арреніуса але за Бренстедом кислота виявляє свої властивості і у відсутності розчинника. Речовина може віддавати протон не тільки у водному середовищі, але і в неводних розчинниках, в газоподібному або твердому станах.
Реакція між кислотою і основою, згідно теорії, є боротьбою за протон між двома основами. Для того, щоб кислота змогла віддати свій протон, необхідна наявність основи, здатної його прийняти. При цьому аніон кислоти як частинка, що приєднує протон, також виступає в якості основи:
СН3СОONa + H2SO4 ↔ СН3СОOH + NaHSO4
основа1 кислота2 кислота1 основа2
Роль основи може відігравати і розчинник :
СН3СОOH + Н2О ↔ СН3СОO- + H3О
кислота1 основа2 основа1 кислота2
Якщо у розчиненої речовини кислотні властивості, вода поводить себе як основа. При розчиненні речовин, які виявляють основні властивості, вода може віддавати протон, тобто відігравати роль кислоти:
NH3 + H2O ↔ NH4+ + OH-
основа1 кислота2 кислота1 основа2
Поняття "нейтральність" чи "нейтралізація" в даній теорії не мають чітко визначеного змісту, оскільки будь-яка протонна рівновага веде до утворення нових кислот і основ.
Було запропоновано вважати нейтральними розчини, в яких абсолютна кислотність або основність розчинених речовин менше ніж кислотність і основність розчинника. Згідно з цим визначенням речовини, що відіграють роль середовища (розчинника), є нейтральними. Нейтральними можна також вважати розчини ацетону або спирту у воді, оскільки здатність віддавати або приєднувати протон у ацетона і спирта, нижча ніж у води.
Інший підхід до трактування кислот і основ запропонував Льюїс. Припускаючи, що наявність протону не є основною ознакою кислотності, він обгрунтував електронний механізм кислотно-основних реакцій.
За Льюїсом кислота - це речовина, що здатна прийняти електронну пару з утворенням ковалентного зв'язку, а основа - речовина, що здатна надати електронну пару для утворення ковалентного зв'язку.
Будь-яка рівновага, що описується електроно-донорним механізмом, розглядається як кислотно-основна.
В реакції:
![]()
іон гідрогену є кислотою (акцептор електронної пари), а гідроксид-іон - основою (донор електронної пари).
Взаємодія фториду бора (ВF3) з аміаком (NН3), за Льюїсом, є також кислотно-основним процесом:

Було показано, що такий процес може бути доведений до кінця у присутності забарвленого індикатору, аналогічно титруванню протонної кислоти або основи, що містить ОH--іони.
Згідно теорії Льюїса практично всі реакції приєднання можна розглядати як кислотно-основні. При цьому дисоціація продуктів, що утворилися, не є обов'язковою ознакою кислотності або основності.
Але незважаючи на ряд слабких ланок, теорія Льюїса використовується при поясненні кислотно-основних процесів поряд з протонною теорією і теорією Арреніуса. Інші теорії не знайшли широкого застосування, хоча деякі з них виявились корисними при розгляді окремих етапів хімічної взаємодії в розчинах і дали можливість виявити загальний характер явиш, які здавались на перший погляд дуже різними. Прикладом може бути теорія сольвосистем, в основу якої покладені властивості розчинника
4.4 Типи протолітичних реакцій: нейтралізації, гідролізу та
йонізації. Гідроліз солей. Роль гідролізу в біохімічних процесах.
! Реакціями нейтралізації називають обмінні реакції взаємодії кислот і основ, в результаті яких утворюються сіль і вода.
Розглянемо різні типи реакцій нейтралізації.
1. Нейтралізація сильної основи сильною кислотою, наприклад
КОН + НNОз = КNО3 + Н2О; ∆G0 = —80 кДж/моль.
молекулярно-іонне рівняння такої реакції Н+ + ОН- = Н2О
Негативне значення енергії Гіббса ∆G0 показує, що рівновага практично повністю зміщена у бік утворення води.
Найбільш загальним випадком реакцій нейтралізації є взаємодія кислот і підстав, що розрізняються по силі (ступені дисоціації). Ці реакції не доходять до кінця унаслідок протікання зворотної реакції гідролізу соли.
2. Нейтралізація слабкої кислоти сильною основою.
Наприклад
HCN + KOH ↔ KCN + H2O
У молекулярно – йонном вигляді:
НСN + ОН- ↔ СN- + Н2О
В даному випадку реакція нейтралізації обернута. Обернута і реакція нейтралізації слабкої основи сильною кислотою:
НС1 + NН3 • Н20 ↔ NН4С1 + Н2О
Або в молекулярно-йонном вигляді:
Н+ + NНз.Н2О ↔ NН4+ + Н2О
а також — слабкої основи слабою кислотою:
СНзСООН + NНз.H2O ↔ СН3СООNН4 + Н2О
Або в молекулярно-йонном вигляді:
СНзСООН + NН3.Н2О ↔ СНзСОО- + NН4+ + Н2О
У даних системах рівновага сильно зміщена управо, оскільки вода (Кд = 1,8 .10-16 ) значно слабкіший електроліт, ніж синильна кислота (Ка= 4,9.10-10), аміак (Кв = 1,8 .10-5) і оцтова кислота (Ка = 1,8. 10-5).
Реакції нейтралізації лежать в основі методу нейтралізації. Цей метод використовують в клінічних лабораторіях для визначення кислотності шлункового соку, буферної емності плазми крові. У фармації його застосовують для кількісного аналізу неорганічних кислот - соляною, сарною, бором і органічних кислот, - оцтовою, бензойною, винною, лимонною, саліциловою. У біофармацевтичних дослідженнях методом нейтралізації визначають рКа кислот і рКв основ, оскільки по значенню цих величин можна прогнозувати здатність лікарських препаратів проходити через біологічні мембрани.
Застосовують кислотний-основне титрування для визначення рКа амінокислот і рКа дисоціюючих груп, що входять в білки. По кривим титрування білків, отриманим при двох різних температурах, можна визначити число карбоксильних, імідазольних і інших груп. Титрування амінокислот і білків дає можливість визначити їх ізоелектричні крапки.
Реакції гідролізу
У загальному випадку під гідролізом розуміють реакції розкладання речовини водою.
Гідроліз - окремий випадок сольволізу - взаємодії розчиненої речовини і розчинника.
Гідролізу можуть піддаватися хімічні сполуки різних класів: білки, жири, вуглеводи, ефіри, соли і т.д. В неорганічній хімії найчастіше зустрічаються з гідролізом солей:
! гідролізом солі називають взаємодію соли з молекулами води, що приводить до утворення малодисоційованих сполук.
З погляду протеолітичної теорії кислот і основ гідроліз є окремий випадок оборотної рівноваги. Процес гідролізу полягає в переході іона від молекули води до даного іона
(СО32- + НОН ↔ НСО3- + ОН-) або від данного йона
(NН4 + НОН ↔ NH3 + Н3О+), зокрема від гідратованого катіона металу [(Fе...ОН2)3+ + НОН ↔ (FеОН) 2+ + Н3О+)] до молекули води. .
Залежно від природи соли вода виступає або як кислота, або як основа, а сіль є відповідно зарядженою основою або зв'язаною кислотою. Наприклад, при гідролізі Nа2СОз:
CO32- + HOH ↔ HCO3- + OH-
основа 1 кислота 2 кислота I основа 2
Процес полягає в переході протона від Н2О (кислота 2) до CO32- (спряжена основа 1).
При гідролізі NН4С1:
NH4+ + HOH ↔ NH3 + H3O+
кислота I основа 2 основа 1 кислота 2
Протон переходить від NH4+ (кислота 1) до НОН основа 2).
Можливі чотири варіанти гідролізу залежно від типу солей :
1. Соли, утворені сильною кислотою і слабкою основою. Наприклад
NH4 С1 + HOH ↔ NH3.Н2О + HС1
NH4+ + HOH ↔ NH3 + H3O+ (рН < 7 )
2. Соли, утворені сильною основою і слабкою кислотою. Наприклад
СНзСООNа + НОН ↔ СН3СООН + NаОН
СНзСОО- + НОН ↔ СНзСООН + ОН- (рН > 7 ) ,
З прикладів видно, що реакція середовища в результаті гідролізу визначається тим продуктом, який є сильнішим електролітом.
