
- •1.2 Періодичний закон і періодична система елементів.
- •1. Енергія і розмір орбіталі і електронної хмари характеризуються головним квантовим числом n.
- •2. Форма орбіталей і хмар характеризується побічним (орбітальним) квантовим числом l.
- •3. Магнітне квантове число m I характеризує напрям орбіталей (електронних хмар) в просторі.
- •3. Соли, утворені слабкою кислотою і слабкою основою.
- •1. Сіль містить комплексний катіон
- •2. Сіль містить комплексний аніон
- •Кальцій
- •Токсична дія
- •2. Токсична дія
Біонеоганічна хімія
Лекція № 1 . Вступ до біонеорганічної хімії
1.1 Загальні відомості про біогенні елементи. Якісний та кількісний вміст біогенних елементів в організмі людини. Макроелементи, мікроелементи та домішкові елементи. Вчення В.І. Вернадського про біосферу та роль живої речовини (живих організмів). Зв'язок між вмістом біогенних елементів в організмі людини та їхнім вмістом у довкіллі.
1.2 Періодичний закон і періодична система елементів.
1.3 Знаходження в періодичній системі біоелементів, будова атомів біоелементів.
1.1 Загальні відомості про біогенні елементи. Якісний та кількісний вміст біогенних елементів в організмі людини. Макроелементи, мікроелементи та домішкові елементи. Вчення В.І. Вернадського про біосферу та роль живої речовини (живих організмів). Зв'язок між вмістом біогенних елементів в організмі людини та їхнім вмістом у довкіллі.
По В. І. Вернадському, біосфера - це певним чином організоване середовище, перероблене живими організмами, космічними випромінюваннями і пристосована до життя. Її верхня межа (тропосфера) знаходиться на висоті 12-15 км., нижня (літосфера) - на глибині до 5 км. Отже, сфера включає нижню частину атмосфери, всю гідросферу і верхню частину літосфери, поширеність хімічних елементів в земній корі різноманітна. Порівняльне невелике число елементів складають земну кору. Близько 50 % маси земної кори доводиться на кисень, більше 25 % - на кремній. Вісімнадцять елементів - кисень, кремній, алюміній, залізо, кальцій, натрій, калій, магній, водень, титан, вуглець, хлор, фосфор, сіра, азот, марганець, фтор, барій - складають 99,8 % маси земної кори. На долю решти всіх елементів доводиться лише 0,2 %.
Згідно В. І. Вернадському, живі організми (жива речовина) беруть активну участь в перерозподілі хімічних елементів в земній корі. Мінерали, природні хімічні речовини утворюються в біосфері в різних кількостях завдяки діяльності живої речовини.
Прикладом геохімічної ролі живої речовини є кальцієва функція, характерна для всіх організмів, що мають кальций-фосфатний (карбонатний) скелет. Концентруючи кальцій в своїх тілах, живі організми енергійно витягують його з навколишнього середовища. Іншим прикладом геохімічної ролі живої речовини є утворення гірських порід, наприклад залізняку, в результаті діяльності мікроорганізмів.
Вивчаючи геохімічні перетворення в земній корі, В. І. Вернадській встановив, що зміни, що відбуваються у верхніх шарах земної кори, надають певний вплив на хімічний склад живих організмів. Дослідження хімічного складу земної кори, ґрунту, морської води, рослин, тварин, людини показали, що в живих організмах, у тому числі і у людини, можна виявити майже всі ті ж елементи, які є в земній корі і морській воді. Таким чином, були підтверджені припущення В. І. Вернадського про схожість хімічного складу земної кори і живих організмів.
В процесі еволюції від неорганічних речовин до біоорганічних основою використання тих або інших хімічних елементів при створенні біосистем є природний відбір. У таблиці 1 приведені дані про вміст хімічних елементів в земній корі, морській воді, рослинних, тваринних організмах. З таблиці 1 видно, що велику частку речовини живих організмів складають елементи, які мають досить високу поширеність в земній корі . Проте ця закономірність дотримується не завжди. Так, в земній корі міститься багато кремнію (27,6%), а в живих організмах його мало. Аналогічно і для алюмінію, який у великих кількостях міститься в земній корі (7,45 %) і в дуже незначних (1 • 10-5%), - в живих організмах.
Таблиця № 1
Вміст хімічних елементів в земній корі, ґрунтах, морській воді, рослинах та тваринах. ( за А.П. Виноградову).
Елемент
|
Земна кора |
Ґрунт |
Морська вода |
Рослини |
Тварини |
 Непропорційний вміст
елементів в організмі пояснюється
тим, що на засвоєння елементів впливає
розчинність їх природних з'єднань у
воді. Природні сполуки
кремнію SiО2,
алюмінію Аl2О3
практично нерозчинні
, тому вони не засвоюються живими
організмами. Спостерігається
і зворотна картина, наприклад, вуглець
в незначних кількостях міститься в
земній корі (0,35%), а по
вмісту в
живих організмах займає
2-е місце (21 %).
Непропорційний вміст
елементів в організмі пояснюється
тим, що на засвоєння елементів впливає
розчинність їх природних з'єднань у
воді. Природні сполуки
кремнію SiО2,
алюмінію Аl2О3
практично нерозчинні
, тому вони не засвоюються живими
організмами. Спостерігається
і зворотна картина, наприклад, вуглець
в незначних кількостях міститься в
земній корі (0,35%), а по
вмісту в
живих організмах займає
2-е місце (21 %).
Збільшений вміст елементу в організмі в порівнянні з навколишнім середовищем називають біологічною концентрацією елементу.
В результаті природного добору основу живих систем складають тільки шість елементів: вуглець, водень, кисень, азот, фосфор, сірка, що отримали назву органогенов. Ці елементи складають в організмі 97,4%.
Органогеном номер 1, поза сумнівом, є вуглець. Він здатний утворювати міцні ковалентні зв'язки. Кисень і водень скоріше слід розглядати як носіїв окислювальних і відновних властивостей органічних сполук вуглецю. Співвідношення кисню і водню в біомолекулах визначає тенденцію цих сполук до диспропорціонування і взаємодії їх з водою - середовищем живих організмів.
Решта три органогена - азот, фосфор і сірка, а також деякі інші елементи - залізо, магній, що становлять активні центри ферментів, як і вуглець, дуже лабільни.
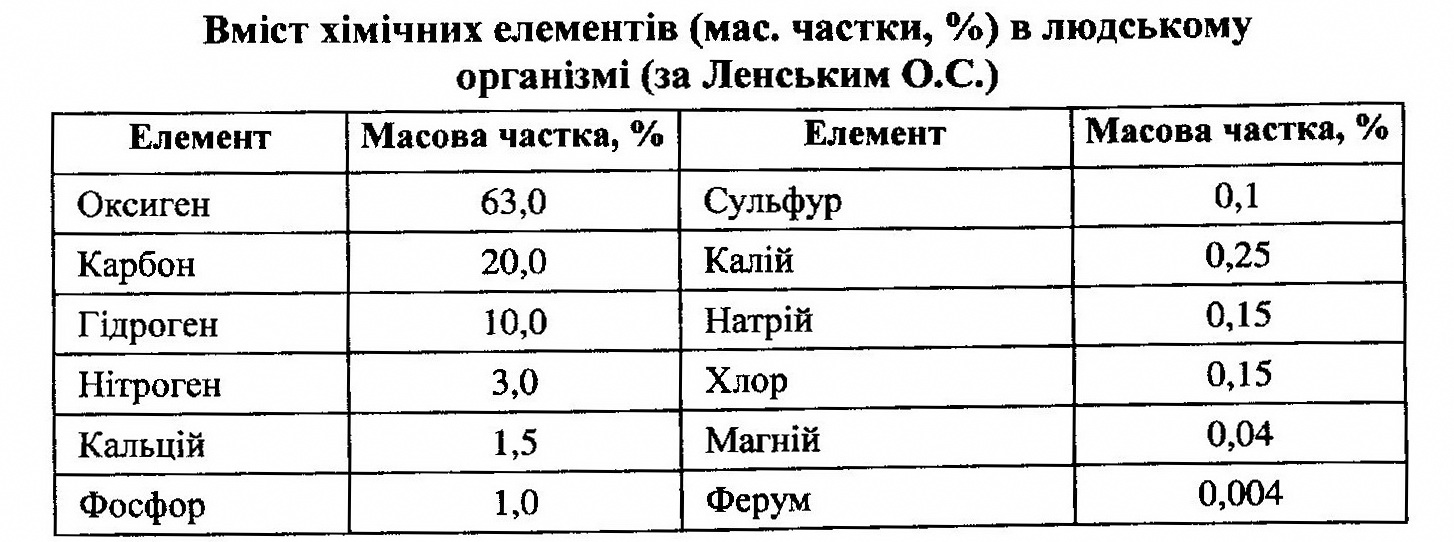
Сучасними фізико-хімічними методами встановлено, що в живих організмах, їхніх тканинах і органах у тій чи іншій кількості знаходяться більше 70% відомих хімічних елементів, причому 99% маси людського тіла становлять так звані макроелементи(табл.2).
Як видно з табл. 2, маса людського тіла на 93 % складається з чотирьох елементів: Карбону, Оксигену, Гідрогену і Нітрогену; ще 2,85 % складають Кальцій, Фосфор, Сульфур, Калій. І тільки близько 1 % маси людського тіла припадає на Натрій, Хлор, Магній, Ферум та інші елементи періодичної системи.
За кількісним вмістом в організмі хімічні елементи умовно поділяють на макроелементи [10-2 % мас. і більше] - це С, Н, О, N. Р, S, Na, Са, К, Мg, СІ - і мікроелементи [10-3 – 10-12 % мас. і менше] - це Мn, Сu, Zn, Со, Fе, І, Мо та ін. Елементи, що містяться в кількостях менш 10-12 % мас., іноді називають ультрамікроелементами. Однак така класифікація не вказує на роль і значення в організмі того чи іншого елемента.
А.П.Виноградов вважає, що біологічна активність і кількісний вміст хімічних елементів у живому організмі знаходяться в зв'язку з їх атомною будовою.
Таблиця № 2
В.В.Ковальський по вивченості і значенню поділяє хімічні елементи на три групи.
I група: О, С, Н, N, Са, Р, К, S, Сl, Nа, Мg, Zn, Fе, Сu, І, Мn, V, Мо,Со, Sе. Ці елементи постійно знаходяться в живих організмах, приймають участь в обміні речовин і є незамінними;
II група: Sr, Cd, Вr, F, В, Sі, Сг, Ве, Nі, Li, Сs, Sn, А1, Ва, Rb, Ті, Аg,Gа, Gе, As, Нg, Рb, Ві, Sb, U, Тh, Rа. Вони також постійно містяться в живих організмах, але їхня біологічна роль або мало вивчена, або невідома;
III група: Sс, Тl, Nb, Те, Lа, W, Аu, Іn, Nd, Sm і ін. Постійно знаходяться в живих організмах, але їхня біологічна роль не з'ясована.
1.2 Періодичний закон і періодична система елементів.
1 березня 1869 року Д.І. Менделєєва сформулював свій закон і графічно зобразив його у вигляді Періодичної системи елементів :
Властивості елементів, а також форми і властивості сполук атомів знаходяться в періодичній залежності від величини атомної маси елементів.
Сучасна періодична система містить 109 хімічних елементів ( з 116 елементів, відкритих до цього часу).
Кожен елемент займає певне місце і має свій порядковий номер, наприклад :
Періодична система складається з 7 періодів і 8 груп ( коротка форма містить 10 рядів - непарні і парні).
Період - це послідовність елементів, яка починається лужним металом і закінчується інертним газом.
Періоди розділяють на великі малі(1,2,3) і великі (4,5,6), 7 - незавершений.
У 6, після лантану знаходяться 14 елементів, звані лантаноїдами. У 7, після актинія знаходяться 14 елементів, звані актиноїдами. У кожному періоді зліва на право металеві властивості елементів зменшуються, а неметалічні збільшуються.
Група - це сукупність елементів, які мають однакову вищу валентність в оксидах і в інших сполуках. Ця валентність рівна номеру групи.
Є виключення Cu(II), Ag(III), Au(III), N(IV), O(II).
Кожна група складається з 2 підгруп : головної і побічної ( містить елементи тільки великих періодів).
У головних підгрупах зверху вниз металеві властивості посилюються, а неметалічні ослабляються. Всі елементи побічних підгруп є металами.
1.3 Знаходження в періодичній системі біоелементів, будова
атомів біоелементів.
Рис.
1. Электронное облако водорода с
неравномерной плотностью
Електронна оболонка атома - це сукупність всіх електронів в даному атомі.
У 20-х роках XX в. учені встановили, що електрон має подвійну природу: він є одночасно частинкою і хвилею . Уявлення про подвійну природу електрона привело до створення квантово-механічної теорії будови атома.
Головну тезу квантової механикі - мікрочастки мають хвилеву природу, а хвилі - властивості частинок. Стосовно електрона можна сказати, що він поводиться і як частинка, і як хвиля тобто він володіє, як і інші мікрочастки, корпускулярно-хвильовим дуалізмом (подвійністю). З одного боку, електрони як частинки чинять тиск, з іншого боку, рухомий потік електронів виявляє хвилеві явища, наприклад дифракцію електронів. Дифракція електронів широко використовується при вивченні будови речовини (наприклад, в електронних мікроскопах).
Квантова механіка розглядає вірогідність знаходження електрона в просторі навколо ядра. Швидко рухомий електрон, що володіє властивостями хвилі, може знаходитися в будь-якій частині простору, що оточує ядро, і різні положення його розглядаються як електронна хмара з певною щільністю негативного заряду. Щільність електронної хмари нерівномірна. Максимальна щільність відповідає найбільшій вірогідності знаходження електрона в даній частині атомного простору. На мал. 1 зображений поперечний перетин атома водню з погляду квантової механіки. З малюнка видно, що поблизу ядра електронна щільність практично рівна нулю, тобто електрон тут майже не буває. У міру видалення від ядра електронна щільність зростає і досягає максимального значення на відстані 0,053 нм, а потім поступово падає.
Значить, на відстані 0,053 нм від ядра найбільш вірогідне знаходження рухомого електрона (на малюнку більш затемнені місця). Чим міцніше зв'язаний електрон з ядром, тим більше щільним по розподілу заряду і меншим за розміром повинна бути електронна хмара.
Частина атомного простору, в якій вірогідність знаходження даного електрона найбільша (рівна F 90%), називається атомною орбіталью.
Кожен електрон в атомі займає визначену орбіталь і утворює електронну хмару, яка є сукупністю різних положень швидко рухомого електрона.
Хімічні властивості елементів визначаються будовою електронних оболонок їх атомів.
Квантові числа. Принцип Паулі
Для характеристики орбіталей і електронів використовуються квантові числа.
