
- •Класифікація розчинників
- •Константи сполучених кислот і основ
- •Відповідно для основ маємо
- •Автопротоліз амфіпротонних розчинників
- •Кислоти і основи в розчинах-амфолітах. Сильні і слабкі протоліти
- •Значення і для деяких протолітичних пар у водних розчинах
- •РН розчинів сильних протолітів
- •Значення функції кислотності Гаммета для системи при температурі 25° с
- •РН розчинів слабких кислот
- •Розрахунок рН розчинів слабких основ
- •Розрахунок рН розчинів амфолітів
- •Розрахунок рН буферних розчинів
- •Розведення буферного розчину
- •Розрахунок буферної ємності
Значення функції кислотності Гаммета для системи при температурі 25° с
-
Концентрація
М %
Концентрація
М %
1,08
10
–0,31
7,1
50
–3,38
1,68
15
–0,66
9,1
60
–4,46
1,96
17,8
–0,88
10,3
65
–5,04
2,32
20
–1,01
11,5
70
–5,65
3,73
30
–1,72
12,7
75
–6,30
4,12
32,6
–1,90
14,1
80
–6,97
5,3
40
–2,41
16,6
90
–8,27
5,5
40,8
–2,48
18,6
100
–11,10
РН розчинів слабких кислот
Для обчислення рН розчинів слабких протолитов необхідно знати їхню загальну концентрацію в розчині і константу їхньої дисоціації.
Для слабкої кислоти
![]() .
(1.69)
.
(1.69)
З рівняння (1.69) видно, що концентрації йонів, що утворилися, у розчині однакові, тобто
![]() .
(1.70)
.
(1.70)
Концентрація недисоційованої кислоти дорівнює різниці між загальною концентрацією і концентрацією дисоційованих молекул.
![]() ,
(1.71)
,
(1.71)
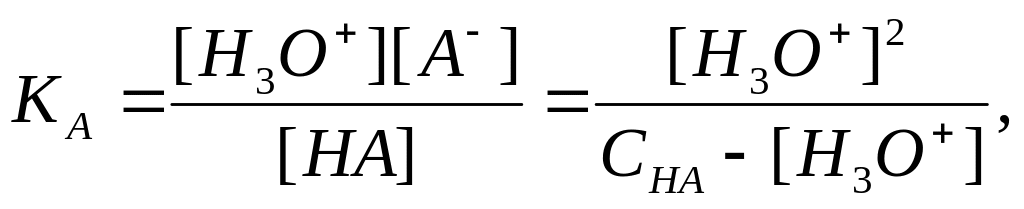 (1.72)
(1.72)
![]() .
(1.73)
.
(1.73)
Вирішуючи квадратне рівняння, одержимо значення , а потім рН
![]() (1.74)
(1.74)
Формула (1.74) застосовна до будь-яких розчинів слабких кислот, якщо їхня концентрація > 10-6 М. Ця формула спрощується, якщо кислота слабодисоційована.
Приймаючи,
що
![]() (1.75),
(1.75),
рівняння (1.72) спрощується:
![]() ,
(1.76)
,
(1.76)
![]() (1.77)
(1.77)
Формула
(1.77) застосовується, якщо ступінь
дисоціації кислоти менше 5
% чи
![]() .
.
Приклад
1.
Розрахувати рН 0,1
M розчину оцтової кислоти
![]()
![]() .
.
Оскільки ступінь дисоціації < 5%, то
![]() ,
,
![]() .
.
Приклад
2.
Розрахувати рН 0,1 M розчину дихлороцтової
кислоти
![]() .
.

![]()
Обчислюємо за формулою (1.73):
![]()
![]()
![]() .
.
Приклад 3. Розрахувати 0,01 М розчину хлористоводневого піридину
![]()
![]() ,
,
![]() ,
,
![]() .
.
Приклад 4. Розрахувати рН у водному розчині 0,1 М хлориду амонію.
рН розчину визначається протолізом йонів амонію:
![]() ,
,
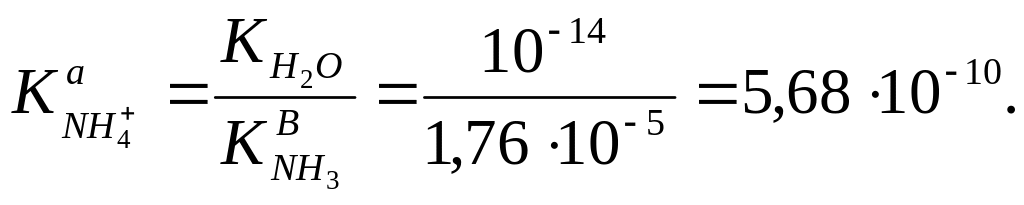
Тому
що![]() – дуже слабка катіонна кислота, то
– дуже слабка катіонна кислота, то
![]() ,
,
![]() ,
,
![]() .
.
У
розведених розчинах
![]() слабких кислот з
слабких кислот з![]() не можна нехтувати дисоціацією розчинника.
Відповідно до умови електронейтральності
не можна нехтувати дисоціацією розчинника.
Відповідно до умови електронейтральності
![]()

![]()
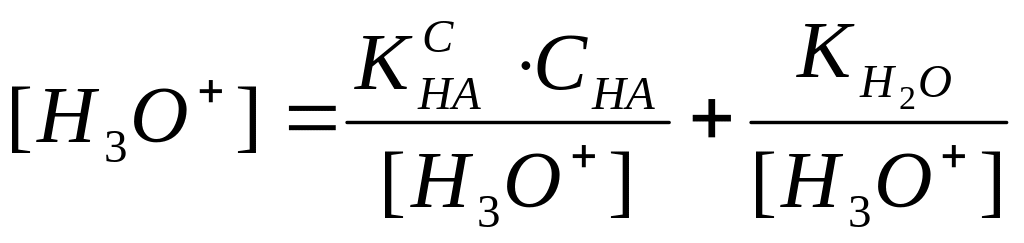
![]()
![]() .
.
Приклад
5.
Розрахувати
![]() розчину фенолу
розчину фенолу
![]() .
Дуже слабка кислота
і розведений розчин
.
Дуже слабка кислота
і розведений розчин
![]() .
.
![]()
Якби в цьому випадку не врахували дисоціацію води, то одержали б
![]()
рН = 7,0.
Таким чином, фенол є дуже слабкою кислотою, і при розрахунку рН у його розчині потрібно враховувати процес дисоціації води.
