
- •Класифікація розчинників
- •Константи сполучених кислот і основ
- •Відповідно для основ маємо
- •Автопротоліз амфіпротонних розчинників
- •Кислоти і основи в розчинах-амфолітах. Сильні і слабкі протоліти
- •Значення і для деяких протолітичних пар у водних розчинах
- •РН розчинів сильних протолітів
- •Значення функції кислотності Гаммета для системи при температурі 25° с
- •РН розчинів слабких кислот
- •Розрахунок рН розчинів слабких основ
- •Розрахунок рН розчинів амфолітів
- •Розрахунок рН буферних розчинів
- •Розведення буферного розчину
- •Розрахунок буферної ємності
РН розчинів сильних протолітів
У водних розчинах сильні кислоти й основи іонізовані цілком. Для однопротонної кислоти концентрація Н30+ дорівнює концентрації розчиненої кислоти:
![]() ,
(1.51)
,
(1.51)
а
![]() .
(1.52)
.
(1.52)
Приклад 1. Обчислити рН 0,05 М розчину HCl.
![]() М;
М;
![]() .
.
Міркуючи аналогічно, одержуємо для сильної основи
![]() ,
(1.53)
,
(1.53)
![]() ,
(1.54)
,
(1.54)
![]() .
(1.55)
.
(1.55)
Приклад
2.
Обчислити
і
![]()
![]() М
розчину
М
розчину
![]()
![]()
![]() ;
;
![]() .
.
Такі
міркування справедливі тільки в
припущенні, що джерелом Н3О+
і ОН-
є сильні кислоти і основи. Якщо ж
аналітична концентрація сильних
протолітів досягає
![]() М
і менше, джерелом йонів
і
буде не тільки протоліт, а і розчинник.
М
і менше, джерелом йонів
і
буде не тільки протоліт, а і розчинник.
Таким чином,
![]() ,
(1.56)
,
(1.56)
де
отримана за рахунок йонізації кислоти,
![]() – за рахунок води
– за рахунок води
![]() ,
а
,
а
![]()
![]() (1.57)
(1.57)
![]() .
(1.58)
.
(1.58)
Якщо
концентрація
кислоти
не занадто мала, у рівнянні (1.58) можна
зневажити величиною
![]() .
Однак для
.
Однак для
![]() спрощення неможливе, а при
спрощення неможливе, а при![]() джерелом
є вода (табл. 2).
джерелом
є вода (табл. 2).
Таблиця 1.1.2
Концентрація і у розчинах сильних кислот
-



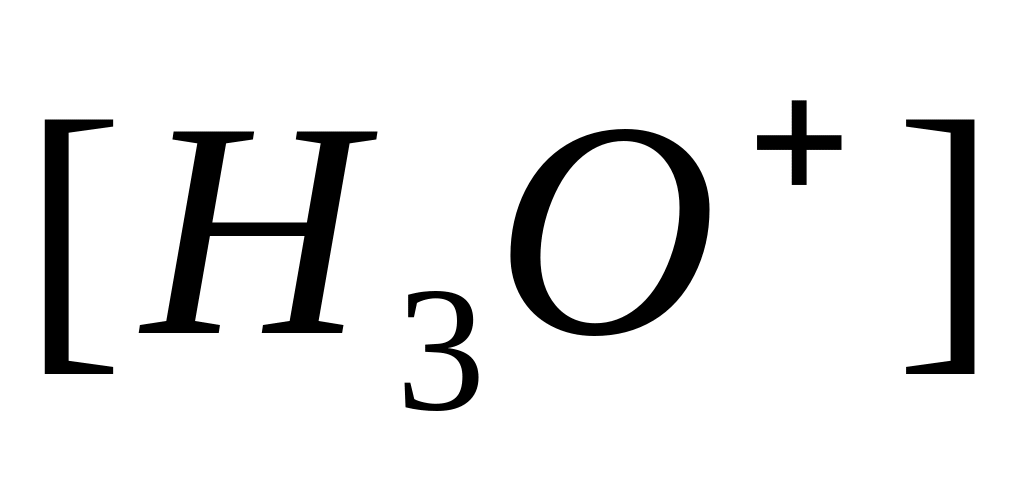
1
1.10-2
1.10-4
1.10-6
5.10-7
2.10-7
1.10-7
5.10-8
1.10-8
1.10-9
0
0
2
4
6
6,3
6,7
7,0
7,3
8,0
9,0
–
10-14
10-12
10-10
10-8
7.10-8
4,2.10-8
6,2.10-8
8,1.10-8
9,5.10-8
9,95.10-7
1.10-7
1
1.10-2
1.10-4
1.10-6
5,07.10-7
2,42.10-7
1,62.10-7
1,31.10-7
1,05.10-7
1,005.10-7
1.10-7
0
2,00
4,00
6,00
6,29
6,62
6,78
6,88
6,98
6,998
7,00
Для обчислення рН розчинів сильних основ використовуємо рівняння
![]() ,
(1.59)
,
(1.59)
![]() (1.60)
(1.60)
![]() .
(1.61)
.
(1.61)
Концентровані розчини сильних кислот не можна характеризувати значенням , тому що коефіцієнт активності менше одиниці, а визначити його незалежним методом важко. Кислотність таких розчинів оцінюється функцією Гаммета Н0, пропорційної рН. Кислотність порівнюється за допомогою індикаторів, що є основою:
![]() ,
(1.62)
,
(1.62)
![]() ,
(1.63)
,
(1.63)
де – константа йонізації В.
![]() (1.64)
(1.64)
Підставляючи (1.64) у (1.63), одержуємо
![]() ,
(1.65)
,
(1.65)
![]() ,
(1.66)
,
(1.66)
![]() ,
,
![]() (1.67)
(1.67)
![]() (1.68)
(1.68)
Тому
що
![]() – величина, постійна для індикаторів
однакової
– величина, постійна для індикаторів
однакової
зарядності,
![]() пропорційно
–
пропорційно
–
![]() .
.
Таблиця 3
