
- •Изменение энтропии идеального газа при изотермическом процессе
- •Теоретическое введение Идеальный газ
- •Первое начало термодинамики
- •Тепловые машины
- •Теоремы Карно
- •Неравенство Клаузиуса
- •Термодинамическая энтропия
- •Закон возрастания энтропии
- •Расчет изменения энтропии для идеального газа
- •Идея метода
- •Упражнение 1. Подготовка к работе.
- •Упражнение 3. Расчет изменения энтропии идеального газа.
- •Упражнение 4. Расчет универсальной газовой постоянной.
- •Список литературы
- •Контрольные вопросы
Закон возрастания энтропии
Применим неравенство Клаузиуса для описания необратимого кругового термодинамического процесса, изображенного на рис 4.
|
Рис. 4. Необратимый круговой термодинамический процесс |
Пусть
процесс
![]() будет необратимым, а процесс
- обратимым. Тогда неравенство Клаузиуса
для этого случая примет вид
будет необратимым, а процесс
- обратимым. Тогда неравенство Клаузиуса
для этого случая примет вид
|
(23) |
Так как процесс является обратимым, для него можно воспользоваться соотношением (21), которое дает
|
(24) |
Подстановка этой формулы в неравенство (23) позволяет получить выражение
|
(25) |
Сравнение выражений (21) и (25) позволяет записать:
|
(26) |
в котором знак равенства имеет место в случае, если процесс 12 является обратимым, а знак больше, если процесс 12 необратимый.
Неравенство (26) может быть также записано и в дифференциальной форме
|
(27) |
Если рассмотреть адиабатически изолированную термодинамическую систему, для которой Q = 0, то выражение (27) примет вид
|
(28) |
или в интегральной форме
|
(29) |
Полученные неравенства (28), (29) выражают собой закон возрастания энтропии, который можно сформулировать следующим образом:
В адиабатически изолированной термодинамической системе энтропия не может убывать: она или сохраняется, если в системе происходят только обратимые процессы, или возрастает, если в системе протекает хотя бы один необратимый процесс. Это утверждение является ещё одной формулировкой второго начала термодинамики.
Таким образом, изолированная термодинамическая система стремится к максимальному значению энтропии, при котором наступает состояние термодинамического равновесия.
Необходимо отметить, что если система не является изолированной, то в ней возможно уменьшение энтропии.
Расчет изменения энтропии для идеального газа
Для идеального газа можно записать
![]() ,
(30)
,
(30)
![]() или
с учетом уравнения (1)
или
с учетом уравнения (1)
![]() (31)
(31)
Подставив (30) и (31) в первое начало термодинамики (4), получим:
![]() (32)
(32)
Для того чтобы найти изменение энтропии для идеального газа подставим (32) в (21)
![]() (33)
(33)
После интегрирования получим
![]() (34)
(34)
Описание установки:
Экспериментальная установка для исследования экспериментальных газовых законов приведена на рис. 5.






















Рис. 5. Схема установки для исследования газовых законов.
1 – стеклянный корпус;
2 – подвижный поршень (шприц находится внутри стеклянного корпуса);
3 – плитка;
4 – датчик давления;
5 – устройство Cobra;
6 – резиновая трубка-переходник;
7, 8 – отверстия в стеклянном корпусе;
9 – магнит;
10 – термодатчик.
В стеклянном корпусе (1) находится шприц с подвижным поршнем (2). Под стеклянным корпусом, не касаясь его, расположена плитка (3). Датчик давления (4), подключают к входу S1 устройства Cobra (5). Короткая резиновая трубка-переходник (6) соединяет датчик давления со шприцом. Этот датчик позволяет автоматически производить измерение давления во внутренней камере шприца. Стеклянную емкость через отверстие (7) заполняют водой. В воду помещают магнитную мешалку. Можно перемешивать воду, обеспечивая равномерный прогрев воздуха во внутренней камере шприца, поднося магнит (9) к стеклянному корпусу (1). В отверстие корпуса (8), закрытое специальной пробкой с отверстием, помещают термодатчик (10), также подключив его к разъему S2 устройства Cobra (5).
Осуществить изотермический процесс можно при комнатной температуре, изменяя объем воздуха в шприце, перемещая поршень (2). Давление при этом будет меняться, что автоматически зафиксирует датчик давления (4). Температуру при этом будет фиксировать термодатчик (10).
Во всех случаях количество воздуха в шприце остается неизменным, то есть = const.



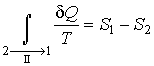 .
. .
.