- •«Экспериментальные газовые законы»
- •Идеальный газ
- •Экспериментальные газовые законы
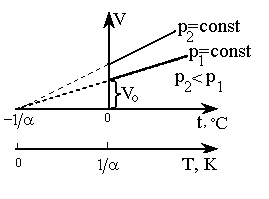
- •2. Закон Гей-Люссака
- •3. Закон Шарля
- •Уравнение состояния идеального газа
- •Идея метода Изучение изотермического процесса (закон Бойля – Мариотта)
- •Изучение изобарического процесса (закон Гей-Люссака)
- •Изучение изохорического процесса (закон Шарля)
- •Упражнение 4. Расчет термического коэффициента давления и объема
- •Изобарный коэффициент расширения.
- •Изохорный коэффициент давления
- •Список литературы
- •Контрольные вопросы
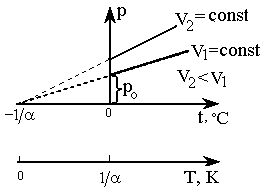
3. Закон Шарля
Для данной массы газа при постоянном объеме V = const давление газа изменяется линейно с температурой (закон Шарля):
![]() (5)
(5)
где ро – давление газа при 0оС, р – давление газа при температуре t, V – термический коэффициент давления газа для изохорического процесса (или изохорный коэффициент давления, или термический коэффициент давления).
Уравнение (5), называемое уравнением изохоры (процесс, происходящий при постоянном объеме, называется изохорическим), выражает закон Шарля. Этот закон был открыт им в 1787 году.
Термический коэффициент давления любого вещества для изохорического процесса определяют как
![]() (6).
(6).
Индекс V у производной показывает, что она берется при V = const. Для идеального газа в соответствии с выражением (5) этот коэффициент будет равен
![]() (7)
(7)
Термический коэффициент объемного расширения представляет собой относительное изменение давления при изменении температуры на 1 К при изохорическом процессе. Относительное изменение давления определяется по отношению к давлению, соответствующему нормальным условиям, то есть при 0оС.
Экспериментально установлено, что для идеального газа
![]() (8).
(8).
Согласно
формулам (2) и (5), изобарический и
изохорический процессы представляются
на графиках прямыми линиями (изобарами
и изохорами) (рис. 2, 3), проходящими
наклонно к оси температур и пересекающими
ее в точке
![]() ,
определяемой из условия 1 + t
= 0. Если перенести начало отсчета в эту
точку, то происходит переход к шкале
Кельвина (рис. 2, 3), откуда Т = t
+
,
определяемой из условия 1 + t
= 0. Если перенести начало отсчета в эту
точку, то происходит переход к шкале
Кельвина (рис. 2, 3), откуда Т = t
+
![]() .
Точка
.
Точка
![]() принята
за начало отсчета новой шкалы температур,
называемой термодинамической шкалой
(шкалой Кельвина), или абсолютной шкалой.
Температура, отсчитываемая по этой
шкале, называется термодинамической;
ноль этой шкалы называется нолем
Кельвина.
принята
за начало отсчета новой шкалы температур,
называемой термодинамической шкалой
(шкалой Кельвина), или абсолютной шкалой.
Температура, отсчитываемая по этой
шкале, называется термодинамической;
ноль этой шкалы называется нолем
Кельвина.
|
Рис. 2. Изобары |
|
Рис. 3. Изохоры |
Вводя в формулы (2), (5) термодинамическую температуру, законам Гей-Люссака и Шарля можно придать более удобный вид:
![]() (9)
(9)
![]() (10).
(10).
Или
![]() для
р
= const,
m =
const, (11)
для
р
= const,
m =
const, (11)
![]() для
V = const,
m =
const (12).
для
V = const,
m =
const (12).
Уравнение состояния идеального газа
Величинами, определяющими состояние газа являются: давление р, под которым находится газ, его температура Т и объем V, занимаемый определенной массой газа. Их называют макропараметрами состояния. Перечисленные три величины не являются независимыми. Каждая из них является функцией двух других. Уравнение, связывающее все три величины - давление, объем и температуру газа для данной его массы, называется уравнением состояния и может быть в общем виде записано так:
f(р, V, T) = 0.
Это значит, что состояние газа определяется только двумя параметрами (например, давлением и объемом, давлением и температурой или, наконец, объемом и температурой), третий параметр однозначно определяется двумя другими. Если уравнение состояния известно в явном виде, то любой параметр можно вычислить, зная два других.
Давление, концентрация газа n и температура связаны между собой как:
p = nkT, (13)
где k – постоянная Больцмана, равная 1,380662.10-23 Дж/К.
Если в объеме V содержится N частиц, то по определению
n = N/V (14)
подставив (13) в (14), получим, что
pV = NkT (15)
Это уравнение, в которое входят все три параметра состояния, и является уравнением состояния идеальных газов.
Его можно преобразовать так, чтобы в него вместо недоступного прямому измерению числа частиц N входила легко измеряемая масса газа m. Для такого преобразования воспользуемся понятием о моле. Молем вещества называется такое его количество, масса которого, выраженная в граммах, равна относительной молекулярной массе М вещества (иногда говорят: молекулярному весу, молярной массе). Моль любого вещества содержит одно и то же число молекул.
Число частиц в одном моле, одинаковое для всех веществ, называется числом Авогадро NА, которое равно
NА = 6,0220943 . 1023 моль-1.
Можно, таким образом, определить моль как единицу особой величины – количества вещества.
Если разделить число молекул N в данной массе газа на число Авогадро NА, то получим число молей в этой массе газа
= N/NА (16)
Но эту же величину можно получить, разделив массу m газа на его молярную массу М
= m/М (17)
Из выражений (16), (17) получим выражение для N:
![]() (18)
(18)
Подставим выражение (18) в формулу (15). Тогда уравнение состояния примет вид:
![]() (19).
(19).
В это уравнение входят две универсальные константы: число Авогадро NА и постоянная Больцмана k. Произведение универсальных констант тоже является универсальной константой. Она получила название универсальной газовой постоянной
R = NАk (20)
R = 8,31414 Дж/(моль.К).
Подставив (20) в уравнение (19), получим:
![]() (21).
(21).
Представленное в таком виде уравнение состояния идеального газа называют уравнением Менделеева – Клапейрона. Это уравнение связывает макроскопические параметры состояния для газа. Уравнение (21) описывает равновесное состояние газа, когда его параметры во всем объеме не зависят от времени (иначе говоря, остаются неизменными по всему объему). Реализовать такие условия трудно. Поэтому определить идеальный газ можно еще и так: газ, подчиняющийся уравнению Менделеева – Клапейрона во всем диапазоне изменения температуры и давления, называется идеальным.
Одна из форм записи уравнения состояния имеет вид
![]() (22)
(22)
Это уравнение носит название уравнения Клапейрона. Согласно этому уравнению произведение давления газа данной массы на его объем, деленное на абсолютную температуру, есть величина постоянная, не зависящая от состояния, в котором находится газ. Сравнив выражения (21) и (22), можно увидеть, что для одного моля газа
![]() .
.
Практическая часть
Экспериментальная установка для исследования экспериментальных газовых законов приведена на рис. 4.
В стеклянном корпусе (1) находится шприц с подвижным поршнем (2). Под стеклянным корпусом, не касаясь его, расположена плитка (3). Датчик давления (4), подключают к входу S1 устройства Cobra (5). Короткая резиновая трубка-переходник (6) соединяет датчик давления со шприцом. Этот датчик позволяет автоматически производить измерение давления во внутренней камере шприца. Стеклянную емкость через отверстие (7) заполняют водой. В воду помещают магнитную мешалку. Можно перемешивать воду, обеспечивая равномерный прогрев воздуха во внутренней камере шприца, поднося магнит (9) к стеклянному корпусу (1). В отверстие (8), закрытое специальной пробкой с отверстием, помещают термодатчик (10), также подключив его к разъему S2 устройства Cobra (5).

















Рис. 4. Схема установки для исследования газовых законов.
1 – стеклянный корпус; 2 – подвижный поршень (шприц находится внутри стеклянного корпуса); 3 – плитка; 4 – датчик давления; 5 – устройство Cobra; 6 – резиновая трубка-переходник; 7, 8 – отверстия в стеклянном корпусе; 9 – магнит;10 – термодатчик.
Осуществить изотермический процесс можно при комнатной температуре, изменяя объем воздуха в шприце, перемещая поршень (2). Давление при этом будет меняться, что автоматически зафиксирует датчик давления (4). Температуру при этом будет фиксировать термодатчик (10).
Изобарический и изохорический процессы можно изучать одновременно. Температуру воздуха в шприце можно увеличить при нагревании воды, находящейся в стеклянном корпусе. Для этого используют плитку (3). Нагревание воздуха в шприце приведет к его расширению, поршень будет перемещаться таким образом, чтобы давление оставалось равным атмосферному (р = const). Фиксируя вручную изменение объема воздуха и соответствующую температуру по показаниям термодатчика (10), можно получить данные о зависимости V(T) для изобарического процесса.
В то же время, можно получить данные о зависимости р(Т) для изохорического процесса, возвращая поршень (2) в исходное положение (к начальному объему, то есть поддерживая V = const) после повышения температуры на определенную величину Т (например, 5К). Давление автоматически будет фиксировать датчик давления (4).
Во всех случаях количество воздуха в шприце остается неизменным, то есть = const.