
- •Контрольные работы № 2 и 3
- •«Общая, неорганическая и физическая химия»
- •Содержание
- •Введение
- •Контрольная работа № 2
- •(Неорганическая химия)
- •Задание 1
- •Строение атомов и периодическая система
- •Контрольные задачи
- •Задание 2 Основные классы неорганических соединений.
- •Контрольные задачи
- •Задание 3. Комплексные соединения
- •Контрольные задачи
- •Задание 4. Электролитическая диссоциация pн-растворов
- •Контрольные задачи
- •Задание 5 Ионно-обменные реакции. Произведение растворимости
- •Контрольные задачи
- •Задание 6 Окислительно-восстановительные реакции
- •Контрольные задачи
- •Контрольные задачи
- •Задание 2 Энтропия. Энергия Гиббса
- •КоНтРольные задачи
- •Задание 3 Влияние температуры на химическое равновесие
- •Контрольные задачи
- •Задание 4 Химическая кинетика и равновесие
- •Контрольные задачи.
- •Фазовые равновесия. Законы Коновалова. Азеотропные смеси.
- •Контрольные задачи.
- •Задание 6 Электропроводность электролитов
Задание 4 Химическая кинетика и равновесие
Кинетика — учение о скорости различных процессов, в том числе химических реакций. Скорость (V) химической реакции - это изменение концентраций реагирующих веществ в единицу времени
V![]()
![]() .
.
Она зависит от: концентрации реагирующих веществ, давления, температуры, действия катализаторов и ингибиторов.
Зависимость скорости реакции от концентрации выражается законом действующих масс и для реакции nA + mB +… = C +… имеет вид:
V = k[A]n[B]m...,
где k - константа скорости реакции; А, В,. . . - реагирующие вещества; n, m, . . . - коэффициенты в уравнении реакции.
Например: для реакции 2SO2 + O2 2SO3 зависимость скорости от концентрации реагирующих веществ имеем V = k[SO2]2 [O2].
Зависимость от температуры для большинства реакций выражается эмпирическим уравнением Вант-Гоффа:
V![]() =
V
=
V![]() (
–
)/10.
(
–
)/10.
где - температурный коэффициент, t1 и t2 - исходная и конечная температуры.
Пример 1
Во сколько раз изменится скорость прямой и обратной реакции в системе:
2 SO2(г) + O2(г) 2SO3(г),
если объем газовой смеси уменьшится в три раза? В какую сторону сместится равновесие системы?
Решение: Согласно закону действующих масс скорости прямой и обратной реакции до изменения объема имеют вид:
Vпр. реакц. = k пр. реакц. [SO2]2 [O2],
Vобр. реакц. = k обр. реакц. [SO3]2
После уменьшения объема системы в три раза концентрация каждого из реагирующих веществ увеличатся в три раза. При новых концентрациях скорости прямой и обратной реакций будут иметь вид:
Vпр. реакц. = k пр. реакц.(3 [SO2])2 3[O2] = 27k[SO2]2 [O2],
Vобр. реакц. = k обр. реакц.(3 [SO3])2 = 9k [SO3]2
Таким образом, скорость прямой реакции увеличилась в 27 раз, а скорость обратной - только в 9 раз. Равновесие системы сместится в сторону образования SО3.
Пример 2
Вычислите, во сколько раз увеличится скорость реакции при повышении температуры от 30 до 700С, если температурный коэффициент реакции равен 2.
Решение. Расчет проведем по формуле:
V = V ( – )/10.
V = V 2(70 – 30)/10 = V 24 = 16 V
Следовательно скорость реакции V при температуре 70°С больше скорости реакции V при температуре 30°С в 16 раз.
Пример 3.
Константа равновесия гомогенной системы
СО(г) + Н2О(г) = СО2(г) + Н2(г)
при 850°С равна 1. Вычислите концентрации всех веществ при равновесии, если исходные концентрации: [СО].= 3 моль/л, [Н2О]. = 2 моль/л.
Решение. При равновесии скорости прямой и обратной реакции равны, а отношение констант этих скоростей постоянно и называется константой равновесия данной системы:
Vnp. = k1[CO][H2О]; Vo6p. = k2[CО2][H2]
Kp
=
![]()
![]()
В условии задачи даны исходные концентрации, тогда как в выражение Кр входят равновесные концентрации всех веществ системы. Предположим, что к моменту равновесия концентрация CO2 станет равной x моль/л. Согласно уравнению реакции концентрация образовавшегося водорода при этом будет также равной х моль/л. В соответствии с уравнением реакции концентрации CO и H2O также уменьшается на x моль. Следовательно, равновесные концентрации всех четырех веществ будут равны:
[СО2] = [Н2] = х моль/л; [СО] = (2-х) моль/л; [Н2О] = (3-х) моль/л.
Зная константу равновесия, находим значение х, а затем равновесные концентрации всех веществ:
1
=
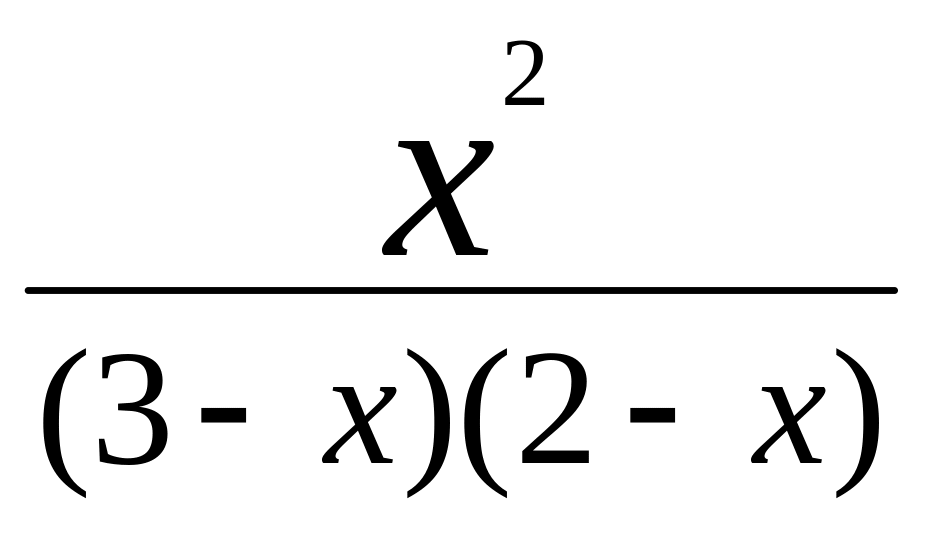 ;
х2
=
6 - 2х - 3х + х2;
5х = 6; х = 1,2 моль/л.
;
х2
=
6 - 2х - 3х + х2;
5х = 6; х = 1,2 моль/л.
Таким образом, равновесные концентрации имеют значения:
[СО2] = 1,2 моль/л; [Н2] = 1,2 моль/л;
[СО] = 3 - 1,2 = 1,8 моль/л; [Н2О] = 2 - 1,2 = 0,8 моль/л.
Пример 4.
Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению:
РС15(г) = РС13(г) + С12(г); Н0298 = +92,59 кДж
Как надо изменить: а) температуру; б) давление; в) концентрации веществ, чтобы сместить равновесие в сторону прямой реакции - разложения РCl5?
Решение: Смещением или сдвигом химического равновесия называют изменение равновесных концентраций реагирующих веществ в результате изменения одного из условий реакции. Направление, в котором сместилось равновесие, определяют по принципу Ле Шателье: если на систему, находящуюся в равновесии, оказать какое-либо воздействие, то в результате протекающих в ней процессов равновесие сместится в таком направлении, что оказанное воздействие уменьшится.
Реакция разложения PCl5 эндотермическая (Н > 0) - для смещения равновесия в сторону прямой реакции нужно повысить температуру. Разложение PCl5 ведет к увеличению объема (из одной молекулы газа образуются две газообразные молекулы) - для смещения равновесия в сторону прямой реакции надо уменьшить давление. Смещения равновесия в указанном направлении можно достигнуть как увеличением концентрации PCl5, так и уменьшением концентраций РСl3 или С12.
