
- •Содержание
- •1. Комплексные соединения
- •Часть вторая. Неорганическая химия лекция 1 комплексные соединения
- •1) Комплексообразователь – центральный атом,
- •2) Лиганды – частицы координированные вокруг комплексообразователя,
- •3) Частицы нейтрализующие заряд комплексного иона. Если заряд комплексного иона равен нулю, то он соответственно состоит только из комплексообразователя и лигандов.
- •Лекция 2 s-элементы
- •1 Общая характеристика s-элементов первой и второй групп
- •Лекция 3 свойства воды
- •1 Строение молекулы воды
- •2 Физические свойства воды
- •3 Химические свойства воды
- •4 Жесткость воды
- •Лекция 4 р-элементы III группы
- •1 Общая характеристика
- •Лекция 5 р-Элементы IV группы
- •1 Общая характеристика
- •2.Углерод образует ряд аллотропных модификаций, из которых наиболее известны алмаз и графит.
- •Вопросы для самоподготовки:
- •Лекция 6 р-Элементы V группы
- •1 Общая характеристика
- •1) Фосфористая(н3ро3) – двухосновная,
- •2) Фосфорноватистая(н3ро2) – одноосновная.
- •Вопросы для самоподготовки:
- •Лекция 7 р-Элементы VI группы
- •Вопросы для самоподготовки:
- •Лекция 8 р-Элементы VII и VII групп
- •1 Общая характеристика
- •2 Химические свойства
- •3 Кислоты
- •4 Общая характеристика р-Элементов VIII группы
- •Вопросы для самоподготовки:
- •Лекция 9 d-металлы I группы
- •1 Общая характеристика d-элементов
- •2 Общая характеристика d-металлов I группы
- •3 Химические свойства
- •Вопросы для самоподготовки:
- •Лекция 10 d-металлы II группы
- •1 Общая характеристика
- •Вопросы для самоподготовки:
- •Лекция 11 d-металлы III группы
- •1 Общая характеристика
- •2 Свойства и применение в технике
- •Лекция 12 d-металлы IV группы
- •1 Общая характеристика
- •Вопросы для самоподготовки:
- •Лекция 13 d-металлы V группы
- •1 Общая характеристика
- •Вопросы для самоподготовки:
- •Лекция 14 d-металлы VI группы
- •1 Общая характеристика
- •Вопросы для самоподготовки:
- •Лекция 15 d-металлы VII группы
- •1 Общая характеристика
- •Лекция № 16 d-металлы VIII группы
- •1 Общая характеристика элементы триады железа
- •3 Платиновые металлы
- •Вопросы для самоподготовки:
- •Дополнительный материал:
- •1 Полимеры
- •21.1 Классификации полимеров
- •21.2 Полимеризационные полимеры
- •21.3 Поликонденсационные полимеры
- •21.4 Структура и состояние полимеров
- •2 Рабочие вещества низкотемпературной техники
- •2.2 Хладагенты органического происхождения
- •Список использованных источников
- •Вопросы к экзамену
- •1. Вопрос (свойства элементов)
- •2 Вопрос (химические реакции)
- •3 Вопрос (типовые задачи)
- •1. Комплексные соединения
- •1) Комплексные соединения.
- •Вычислите жёсткость воды зная, что в 600 л её содержится 65,7 г гидрокарбоната магния и 61,2 г сульфата калия.9
- •Контрольные задачи
3 Платиновые металлы
К платиновым металлам относятся: рутений (Ru), родий (Rh), палладий (Рd), осмий (Оs), иридий (Ir) и платина (Рt). Они являются электронными аналогами cоответствующих элементов триады железа, но значительно уступают им в химической активности. Стандартные электродные потенциалы находятся в интервале +0,45 ÷ +1,2 В. Наименее активны из этих металлов иридий и платина. Проявляют валентности от 1 до 6. Наиболее устойчивые валентности: рутений – 4, родий – 3, палладий – 2, осмий – 6, иридий – 3 и платина – 4. Эти металлы относятся к редким металлам, встречаются в природе преимущественно в самородном состоянии. Окисляются кислородом, хлором и другими окислителями только при высокой температуре. Являются хорошими комплексообразователями.
Платина благодаря тугоплавкости и исключительной коррозионной стойкости используется для изготовления химической аппаратуры. Хорошо растворяет водород, особенно в мелкораздробленном состоянии.
Палладий способен поглощать огромное количество водорода (до 900 объемов на 1 объем металла).
Иридий отличается от платины очень высокой температурой плавления (2450 оС) и большей химической стойкостью. Из сплава (90 % платины и 10 % иридия) изготовлены международные эталоны метра и килограмма.
Вопросы для самоподготовки:
1. Fe→FeSO4→Fe(OH)2→ Fe(OH)3.
2. Fe→FeCl3→FeCl2 →Fe(OH)2.
3. Fe→FeCl2→Fe(OH)2→FeSO4.
4. Fe→Fe2(SO4)3→Fe(OH)3→FeCl3.
5. Fe→FeSO4→Fe(OH)2→FeS.
6. Ni→Ni(NO3)2→Ni(OH)2→NiSO4.
Дополнительный материал:
1 Полимеры
Полимер – это высокомолекулярное вещество, состоящее из многократно повторяющихся одинаковых элементарных звеньев. Исходное вещество, участвующее в образовании составных звеньев полимера, называют мономером. Обобщенная формула полимера записывается в виде –[ЭЗ]n–, где ЭЗ – элементарное звено, а n –степень полимеризации.
Пластмассы – это сложные композиции, которые наряду с полимером содержат различные наполнители и добавки, придающие пластмассе необходимые свойства.
21.1 Классификации полимеров
1 По типу элементов, входящих в элементарное звено:
1) неорганические; 2) органические; 3) элементоорганические.
2 По происхождению:
1) природные (встречаются в природе). Например, натуральный каучук, крахмал, целлюлоза, белки и др.;
2) модифицированные (дополнительно измененные природные полимеры). Например, резина, эфиры целлюлозы;
3) синтетические (полученные методом синтеза). Например, полиэтилен, полистирол, лавсан (полиэтилентерефталат), капрон и др.
3 По характеру соединения элементарных звеньев:
1) линейные; 2) разветвленные; 3) трехмерные сшитые.
4 По отношению к нагреванию:
1) термопластичные; 2) термореактивные.
5 По типу химической реакции, используемой для получения:
1) полимеризационные; 2) поликонденсационные.
21.2 Полимеризационные полимеры
Полимеризация – реакция образования полимера за счет раскрытия двойных или тройных связей в мономере (полиэтилен, поливинилхлорид, полиацетилен) или циклов (капрон).
Полиэтилен – полимер, образующийся при полимеризации этилена:
··· + СН2=СН2 + СН2=СН2 + ··· → ··· –СН2–СН2–СН2–СН2– …
или сокращенно: nСН2=СН2 → (–СН2–СН2–)n.
В зависимости от условий полимеризации различают полиэтилен высокого и низкого давления. Для контакта с пищевыми продуктами допускается только полиэтилен высокого давления. Полиэтилен низкого давления содержит остатки катализаторов – вредных для здоровья человека соединений тяжелых металлов.
К недостаткам полиэтилена относятся: низкая теплопроводность, высокий температурный коэффициент объемного расширения, плохие механические свойства, недостаточная стойкость к свету, бензолу, бензину.
Полипропилен – полимер пропилена, следующего за этиленом гомолога непредельных этиленовых углеводородов:
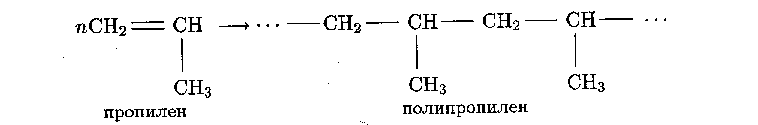
Отличается от полиэтилена более высокой температурой плавления и более высокой прочностью. Используются для электроизоляции, изготовления защитных пленок, труб, шлангов, шестерен, деталей приборов, а также высокопрочного и химически стойкого волокна. Пленки из полипропилена значительно прозрачнее и прочнее полиэтиленовых. Пищевые продукты в упаковке из полипропилена можно подвергать стерилизации, варке и разогреванию. Основной недостаток полипропилена – низкая морозостойкость, поэтому рекомендуемая температура эксплуатации изделий из полипропилена находится в интервале от –15 °С до +100 °С.
Полистирол образуется при полимеризации стирола:
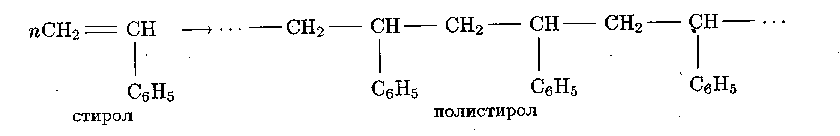
Применяется как органическое стекло, для изготовления промышленных товаров (пуговиц, гребней и т. п.), в качестве электроизолятора.
Полиметилакрилат и полиметилметакрилат – твердые, бесцветные, прозрачные, стойкие к нагреванию и действию света, пропускающие ультрафиолетовые лучи полимеры. Благодаря прочности и легкости называют органическим стеклом.
Каучуки – эластичные материалы, из которых путем специальной обработки получают резину. В технике из каучуков изготовляют шины для автотранспорта.
Натуральный (природный) каучук (НК) является полимером изопрена:
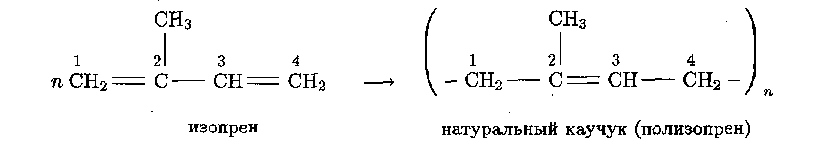
Как видно из приведенной схемы, при полимеризации изопрена раскрываются обе его двойные связи, а в элементарном звене полимера двойная связь возникает на новом месте — между 2 и 3 атомами углерода.
Сырой каучук липок, непрочен, а при небольшом понижении температуры
становится хрупким. Чтобы придать изделиям из каучука необходимую прочность и эластичность, каучук подвергают вулканизации – вводят в него серу и затем нагревают. Вулканизованный каучук называют резиной. При вулканизации сера «сшивает» по двойным связям макромолекулы каучука посредством дисульфидных «мостиков»:
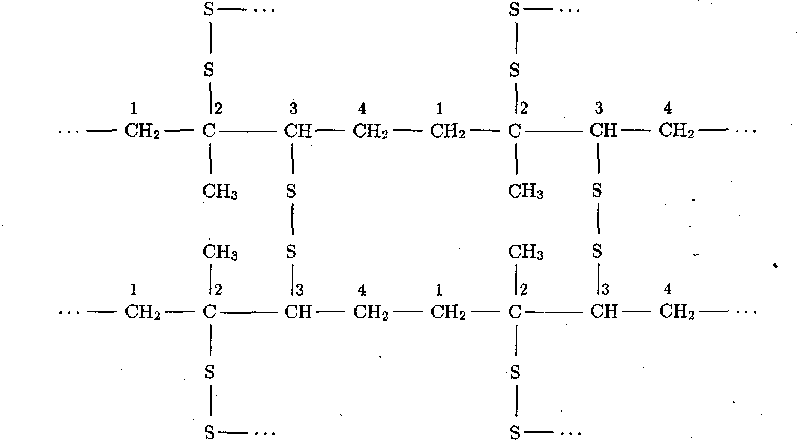
Синтетический каучук производят из дивинила, который полимеризуется подобно изопрену:
nСН2=СН–СН=СН2 → (–СН2–СН=СН–СН2–)n.
В настоящее время химическая промышленность производит много различных видов синтетических каучуков, превосходящих по некоторым свойствам натуральный каучук.
