
- •Предисловие
- •Методические рекомендации по выполнению лабораторных работ Подготовка к выполнению лабораторной работы
- •Выполнение лабораторной работы на занятии
- •Оформление работы
- •Защита лабораторной работы
- •Техника безопасности в химической лаборатории
- •Общие правила поведения в лаборатории
- •Правила работы с химическими реактивами
- •Работа со стеклянной посудой и приборами
- •Работа с ртутными термометрами
- •Техника безопасности при работе с электроприборами
- •Основные правила противопожарной безопасности
- •Химическая посуда
- •Лабораторные работы Работа 1 приготовление растворов. Титриметрический анализ
- •1. Общие понятия
- •2. Способы выражения концентрации растворов
- •3. Титриметрический анализ
- •3.1. Сущность титриметрического метода анализа
- •3.2. Классификация титриметрических методов
- •3.3. Вычисления в титриметрии
- •3.4. Растворы, применяемые в титриметрии. Приготовление стандартных растворов
- •3.5. Аппаратура и техника выполнения титриметрического анализа
- •Выполнение работы. Опыт №1. Приготовление раствора заданной процентной концентрации.
- •Требуется приготовить 100 г раствора заданной процентной концентрации определенного вещества и воды (концентрацию и вещество указывает преподаватель).
- •Рассчитывают, какая масса вещества требуется для приготовления 250 мл раствора указанной концентрации. При расчетах учитывают, что щелочи, как правило, содержат 96–98% основного вещества.
- •3.2. Определение концентрации раствора щелочи
- •Определение теплоты реакции нейтрализации
- •Проведение калориметрических измерений
- •Выполнение работы.
- •Обработка результатов.
- •Термометр Бекмана и работа с ним
- •Химия биогенных s- и p- элементов. Их биологическая роль и применение в медицине
- •Химия биогенных d- элементов. Их биологическая роль и применение в медицине
- •Работа 5 осмос
- •Измерение рН растворов потенциометрическим методом. Потенциометрическое титрование
- •Измерение рН
- •Подготовка прибора эв-74 к работе (Иономер эв-74)
- •Работа 7 определение константы скорости химической реакции
- •Кинетические уравнения реакций первого, второго и нулевого порядка
- •Работа 8 адсорбция уксусной кислоты на поверхности активированного угля
- •Работа 9 получение золя гидроксида железа (III). Коагуляция
- •Работа 10 электрические свойства коллоидных систем
- •Определение знака заряда коллоидных частиц методом капиллярного анализа
- •Выполнение опыта.
- •Электрофорез золя гидроксида железа. Определение знака заряда и величины дзета-потенциала
- •Выполнение работы.
- •Обработка результатов.
- •Задачи для подготовки к семинарским занятиям и контрольным работам
- •Тестовые задания для самоконтроля
Работа 10 электрические свойства коллоидных систем
Определение знака заряда коллоидных частиц методом капиллярного анализа
Поверхность некоторых веществ при погружении в воду приобретает электрический заряд (целлюлоза, шелк, стекло, песок). Так целлюлоза при погружении в воду заряжается отрицательно. На этом явлении основан метод капиллярного анализа. Вода поднимается вверх по полоске фильтровальной бумаги, опущенной одним концом в воду. Поднятие воды по капиллярам бумаги происходит под действием сил поверхностного натяжения. Если в воде находятся отрицательно заряженные коллоидные частицы, то они не притягиваются капиллярами поверхности бумаги и двигаются вверх вместе с водой. Если частицы имеют положительный заряд, то они не будут подниматься, а осядут на поверхности бумаги. Высота и скорость капиллярного подъема зависят также от качества фильтровальной бумаги.
Таким образом, можно определить знак заряда частиц золя. Особенно удобен капиллярный метод для определения знака заряда частиц красителей в их золях.
Кроме определения знака заряды частиц, капиллярный метод можно применять для анализа смесей различных окрашенных веществ. Например, при погружении кончика полоски фильтровальной бумаги в раствор, содержащей смесь флюоресцеина (желтого красителя) и метиленового голубого, по этой полоске будет подниматься только флюоресцеин.
Цель работы.
Определить знак заряда коллоидных частиц красителей методом капиллярного анализа.
Реактивы.
1%-ные растворы красителей:
Фуксин.
Феноловый красный.
Метиленовый синий.
Флюоресцеин.
Конго красный.
Сафранин.
Оборудование и посуда.
Стаканы на 50 мл.
Полоски фильтровальной бумаги.
Выполнение опыта.
В стаканы наливают растворы красителей (примерно по 1 – 1,5 см по высоте). В растворы опускают на 0,5 см полоски фильтровальной бумаги, верхние концы которых закрепляют кнопками на планке. Через час после начала опыта полоски вынимают из растворов и сушат. Измеряют высоту подъема различных красителей и делают вывод о знаке заряда частиц.
Результаты опыта заносят в таблицу. Высушенные полоски фильтровальной бумаги прилагают к отчету.
Таблица 10.1
Наименование красителя |
Высота подъема, см |
Знак заряда частиц («+» или «–») |
Фуксин |
|
|
Феноловый красный |
|
|
Метиленовый голубой |
|
|
Флюоресцеин |
|
|
Конго красный |
|
|
Сафранин |
|
|
Электрофорез золя гидроксида железа. Определение знака заряда и величины дзета-потенциала
На границе раздела твердой фазы и раствора, как правило, возникает двойной электрический слой (ДЭС). Его происхождение может быть двояким. Во-первых, возможна ионизация молекул, составляющих поверхностный слой твердой фазы, например, ионизация молекул H2SiO3, образующихся на поверхности SiO2 в воде. Во-вторых, на поверхности твердой фазы может происходить адсорбция одного из ионов, присутствующего в растворе электролита. При этом на поверхности преимущественно адсорбируются ионы, входящие в состав твердой фазы или близкие к ним по природе. Так на поверхности частиц золя AgCl будут адсорбироваться ионы Ag+ или Cl– в зависимости от того, какие из них имеются в растворе в избытке. Ионы, определяющие заряд коллоидной частицы (гранулы) называются потенциалобразующими. К заряженной поверхности частиц будут притягиваться ионы противоположного знака, т.е. противоионы, образуя двойной электрический слой.
Двойной электрический слой на поверхности коллоидных частиц включает так называемый адсорбционный слой и диффузный слой. Адсорбционный слой образован частью противоионов, которые прочно связаны с ядром мицеллы электростатическими силами (притягивание разноименных зарядов) и адсорбционными силами. Остальные противоионы, благодаря тепловому движению и взаимному отталкиванию, уходят на некоторое расстояние от межфазной границы, образуя диффузный слой ионов, который удерживается у поверхности только электростатическими силами (см. рис.10.1).
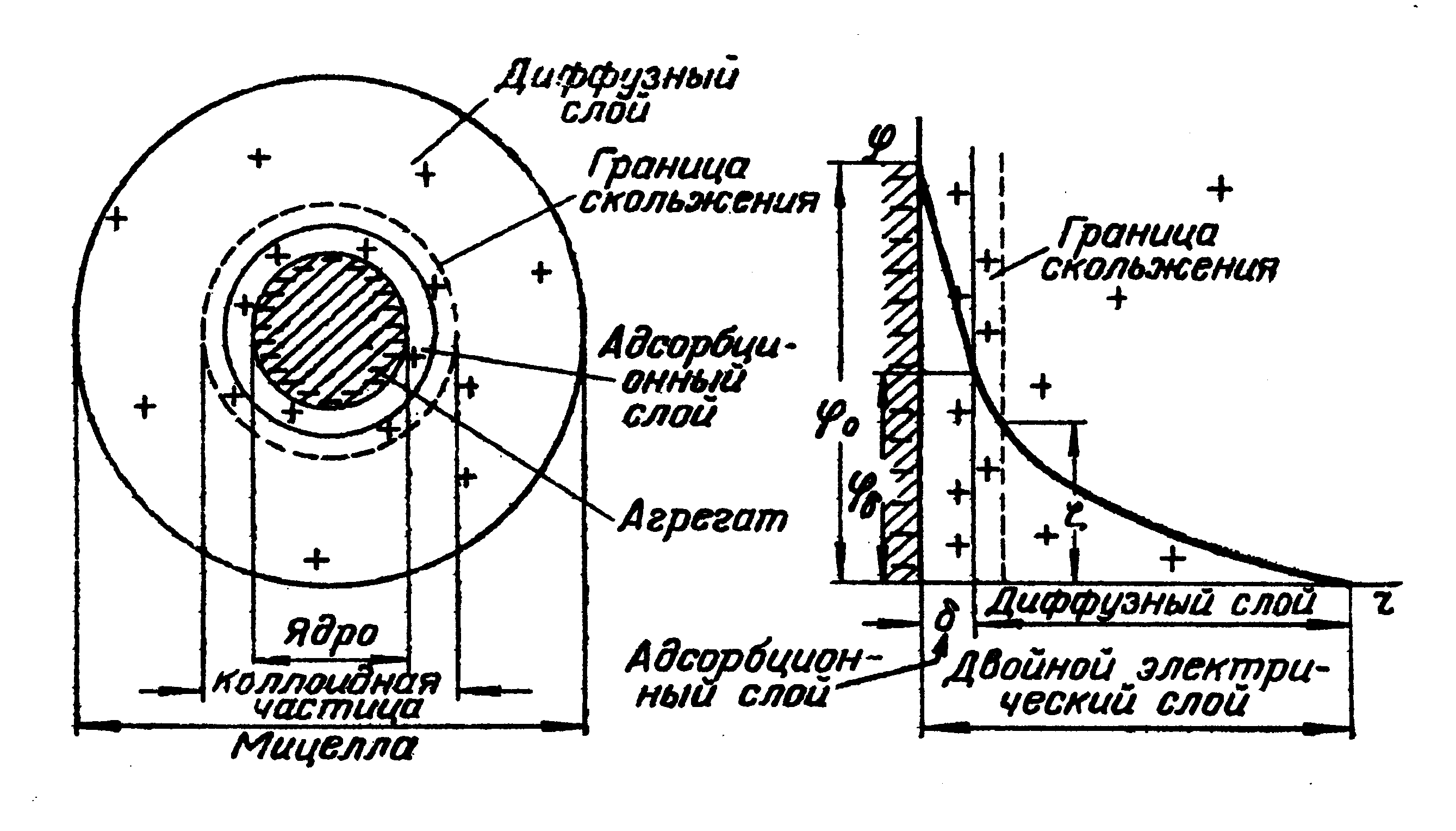
Каждая точка электрического поля двойного слоя, образованного потенциалопределяющими ионами и противоионами, характеризуется определенным значением электрического потенциала. Причем в адсорбционном слое, т.е. на малых расстояниях от поверхности, падение потенциала происходит круто, а далее в диффузном слое более полого.
Наличие заряда у частиц можно обнаружить, помещая коллоидный раствор в постоянное электрическое поле. При этом ядро мицеллы вместе с прочно адсорбированными на нем противоионами движется к одному из электродов, а остальные противоионы перемещаются к другому электроду. Знак заряда частиц легко определить по тому, к какому из электродов они направляются.
Электрофорез – движение заряженных коллоидных частиц в электрическом поле.
Скорость электрофореза зависит от потенциала на границе скольжения, разделяющей две перемещающиеся друг относительно друга части мицеллы.
Потенциал двойного слоя, отвечающий границе скольжения при движении дисперсной фазы и дисперсионной среды относительно друг друга, называется электрокинетическим или -потенциалом (дзета-потенциалом). Место границы скольжения определяется действием адсорбционных и электрических сил, а также свойствами раствора, окружающего частицы, в частности, вязкостью прилегающих слоев жидкости. Граница скольжения может совпадать с границей между адсорбционными и диффузным слоями или находиться несколько дальше от поверхности, где-то в диффузном слое.
Дзета-потенциал является важной характеристикой коллоидных систем. Во многих случаях отмечается закономерность: чем больше величина -потенциала, тем выше устойчивость золя. При значениях -потенциала ниже 0,03 В (критический потенциал) наступает коагуляция золя.
Электрофорез находит широкое применение в медико-биологических исследованиях. В клинической практике электрофоретические методы применяются для диагностики многих заболеваний, для разделения аминокислот, нуклеиновых кислот, антибиотиков, ферментов, антител, для определения чистоты белковых препаратов и т.д.
Цель работы.
Определить знак заряда коллоидных частиц золя гидроксида железа (III).
Вычислить величину электрокинетического потенциала (дзета-потенциала).
Реактивы.
Золь гидроксида железа (III) (см. работу 9).
Оборудование и посуда.
Прибор для наблюдения электрофореза (U-образная трубка).
Медные электроды.
Выпрямитель.
Регулятор напряжения.
Вольтметр.
