
- •Раздел 1
- •Занятие 1
- •Цель занятия
- •Карбонаты щелочных металлов
- •Отделение ионов аммония
- •Действие щелочей и аммиака
- •Оксалат аммония
- •Родизонат натрия (или калия)
- •Занятие 2
- •Цель занятия
- •1. На чем основано разделение катионов согласно кислотно-основной классификации?
- •2. В какой строке перечислены все групповые реагенты, используемые в кислотно-основной схеме анализа?
- •Цель занятия
- •Цель занятия
- •Салициловая кислота (сульфосалициловая кислота)
- •Цель занятия
- •1. В растворе присутствуют hCl (0,1 моль/л) и h3bo3 (0,01 моль/л). Что можно сказать о рН данного раствора?
- •Действие щелочей
- •Действие щелочей
- •Действие щелочей
- •Гексацианоферрат (II) калия
- •Цель занятия
- •1. Что из перечисленного ниже верно? Гидроксиды алюминия, цинка, хрома (III) растворимы в:
- •5. Найдите ряд, в котором содержится больше всего катионов, выпадающих в осадок в виде гидроксидов и оксосолей при обработке анализируемого раствора избытком 6 м NaOh и 6 м nh3.
- •Цель занятия
- •5. Обнаружение анионов scn- и I-
- •Цель занятия
- •Занятие 9
- •Цель занятия
- •1. В насыщенном водном растворе какого из перечисленных ниже веществ равновесная концентрация ионов металла будет наименьшей (в скобках приведены значения ks)?
- •Занятие 10
- •Цель занятия
- •1. Какие из перечисленных ниже процессов невозможны (дайте ответ, не проводя расчётов)?
- •2. Какая из частиц, выделенных полужирным шрифтом, является самым сильным окислителем?
- •3. Какая из частиц, выделенных полужирным шрифтом, является самым сильным восстановителем?
- •7. Какой из малорастворимых электролитов, формулы которых приведены ниже, обладает самым малым произведением растворимости?
- •9. Вывод об отсутствии какого ряда анионов можно сделать, если известно, что при добавлении к анализируемому раствору разбавленного раствора сильной кислоты не происходит выделения пузырьков газа?
- •10. При добавлении к анализируемому раствору ki в кислой среде не происходит появления бурой окраски вследствие выделения иода. Все анионы какого ряда можно не искать при дальнейшем анализе?
- •Занятие 11
- •Цель занятия
- •Предварительные испытания
- •Занятие 12
- •Цель занятия
- •4. Какой из приведенных ниже графиков отражает зависимость константы распределения предельных монокарбоновых кислот между хлороформом и водой в зависимости от числа атомов углерода в молекуле кислоты?
- •2. Экстракция диметилглиоксиматов никеля и кобальта
- •3. Экстракция соединения комплексного аниона [SbCl6]- с малахитовым зеленым
- •4. Экстракционное разделение I- и Br-
- •5. Экстракция ионного ассоциата берберина с трихлорацетат-анионом
- •6. Экстракция ионного ассоциата димедрола с метиловым оранжевым
- •Раздел 2
Салициловая кислота (сульфосалициловая кислота)
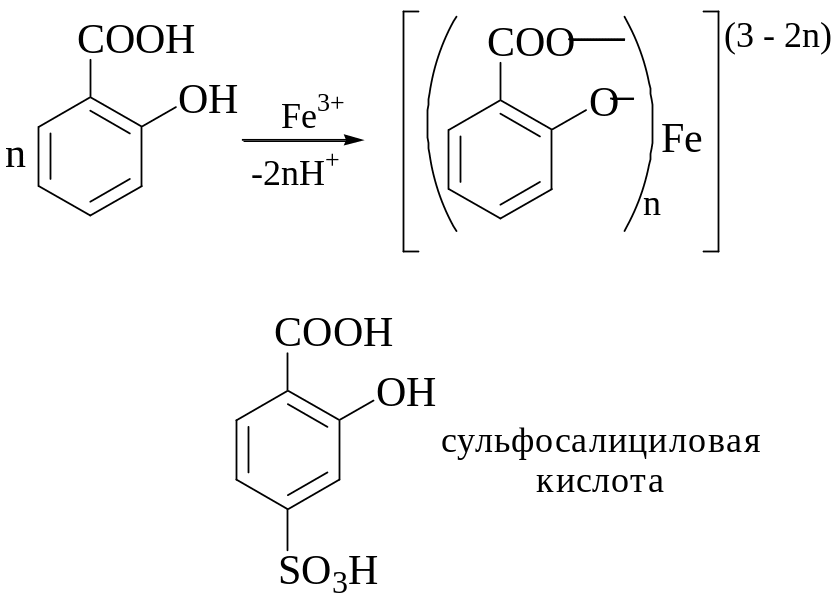
При взаимодействии Fe3+ с салициловой кислотой в зависимости от условий происходит образование комплексов различного состава. При рН 1,8-2,5 образуется буро-фиолетовый моносалицилат железа, при рН 4-7 - красно-бурый цвет дисалицилат железа. В щелочной среде (рН = 8-11,5) образуется жёлтый трисалицилат железа. Сульфогруппа не участвует в процессе комплексообразования, преимуществом сульфосалициловой кислоты перед салициловой является её лучшая растворимость в воде.
К 0,5 мл раствора соли Fe3+ прибавляют 2-3 капли реактива (10% раствор сульфосалициловой кислоты или сульфосалицилата натрия). Если среда раствора слишком кислая и окраска не появляется, добавляют по каплям раствор NH3 до рН 2.
К 3-5 каплям раствора соли Fe3+ прибавляют столько же насыщенного раствора CH3COONa до рН 4-5. Затем добавляют 2-3 капли реактива.
К 3-5 каплям раствора соли Fe3+ прибавляют 2-3 капли реактива и по каплям концентрированный раствор NH3 до перехода окраски раствора в жёлтую.
Реакции ионов Sb3+
1. Протолитическое осаждение
[SbCl6]3- + H2O SbOCl + 5Cl- + 2H+
белый
К 2-3 каплям подкисленного раствора соли сурьмы добавляют 5-6 капель дистиллированной воды и нагревают.
2. Сульфид натрия (сероводород)
2[SbCl6]3- + 3H2S Sb2S3 + 6H+ + 12Cl-
оранжевый
Осадок растворяется в щелочах, концентрированной HCl, в растворах сульфидов щелочных металлов и аммония.
3. Малахитовый зелёный (бриллиантовый зелёный)
[SbCl6]3- + H2O2 + 2H+ [SbCl6]- + 2H2O
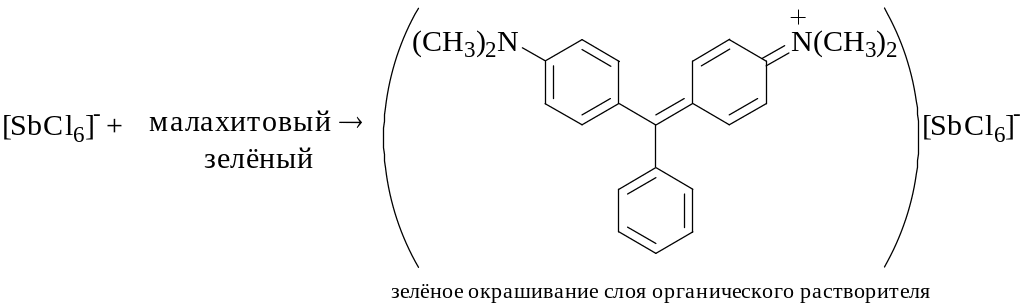
Хлоридный комплекс Sb(III) не образует экстрагирующегося соединения с катионными красителями, поэтому Sb(III) окисляют до Sb(V) действием H2O2, NaNO2 и т.п.
В пробирку помещают 10 капель 0,1% раствора SbCl3 в 6 М HCl, прибавляют 2-3 капли раствора H2O2, 5 капель 0,1% раствора малахитового зеленого, затем 1 мл толуола и перемешивают.
Реакции ионов Bi3+
1. Протолитическое осаждение
Bi3+ + H2O + Cl- BiOCl + 2H+
белый
Методику выполнения реакции см. с. 44.
2. Иодид калия
Bi3+ + 3I - BiI3
чёрный
Осадок растворяется в избытке реагента
BiI3 + KI K[BiI4]
оранжевый
При разбавлении раствора снова выпадает чёрный осадок BiI3 (при сильном разбавлении происходит образование оранжевого осадка BiOI).
3. 8-гидроксихинолин и иодид калия
При взаимодействии Bi3+ c I- образуется [BiI4]-, который затем образует с катионом 8-гидроксихинолина оранжево-красный осадок:
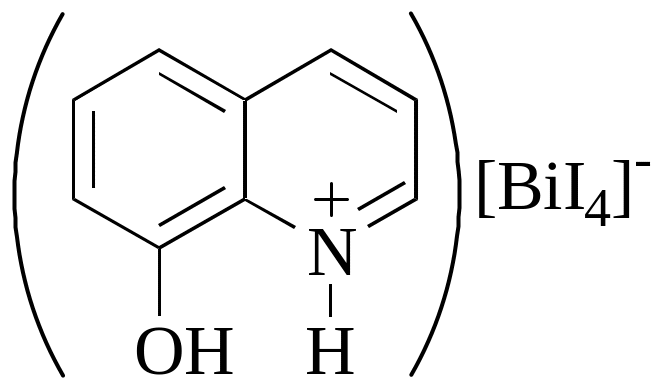
Проведению реакции мешают вещества, окисляющие I- до I2.
Реакцию можно проводить в пробирке или на бумаге.
1. В пробирку вносят несколько капель раствора соли Bi3+ и столько же раствора реагента (смесь KI и 8-гидроксихинолина). К содержимому пробирки добавляют 1 каплю раствора крахмала и, если окраска раствора станет синей, добавляют раствор Na2S2O3 до обесцвечивания.
2. На фильтровальную бумажку, смоченную раствором восстановителя (SnCl2), наносят по 1 капле исследуемого раствора и раствора реагента.
4. Тиомочевина SC(NH2)2
Bi3+ + n SC(NH2)2 {Bi[SC(NH2)2]n}3+
лимонно-жёлтый
Наиболее интенсивную окраску имеет комплекс {Bi[SC(NH2)2]9}3+. Образующиеся соединения достаточно непрочные, поэтому реакцию проводят в присутствии избытка реагента.
К 1 капле раствора соли Bi3+ прибавляют 0,5 мл 5% раствора тиомочевины.
5. Дихромат калия
2Bi3+ + Cr2O72- + 2H2O + 4CH3COO- (BiO)2Cr2O7 + 4CH3COOH
жёлтый
Осадок растворяется в кислотах и не растворяется в щелочах.
ЗАНЯТИЕ 5

