
Радионуклидная диагностика — это раздел медицинской радиологии, который изучает методы исследования функционального и морфологического состояния органов и систем с помощью радиофармацевтических препаратов (РФП).
Основным методом радионуклидной диагностики является радиометрия, которая заключается в регистрации радиометрическими приборами излучения введенных в организм РФП.
В качестве радиоактивных индикаторов используют радионуклиды, которые входят в состав органических или неорганических соединений. Химические соединения, в которых часть нейтральных атомов заменена радиоактивными, называют мечеными соединениями. Используют очень малые в весовом отношении количества радионуклидов (одну стоквадриллионную часть грамма). Такие малые количества получили наименование индикаторных количеств, а обусловлены ими дозы облучения – индикаторных доз. Такие дозы существенно не влияют негативно на организм, не нарушают нормальное течение жизненных процессов и поэтому противопоказаний к их использованию нет за исключением ограничений, предусмотренных НРБУ – 97, беременности, периода лактации, детского возраста.
Химические свойства радионуклидов тождественны свойствам стабильных тех же химических элементов, поэтому и поведение их в организме одинаковое. Изучение метаболизма радиоактивных индикаторов позволяет изучать метаболизм соответствующих стабильных веществ.
Радионуклиды получают в ядерных реакторах, с помощью циклотронов и после очистки и определения удельной активности их в герметически закрытых ампулах в специальных защитных контейнерах направляют в радиологические лаборатории. Выбор индикатора и аппаратуры для радионуклидного исследования зависит от цели исследования.
Получение рфп в генераторе
О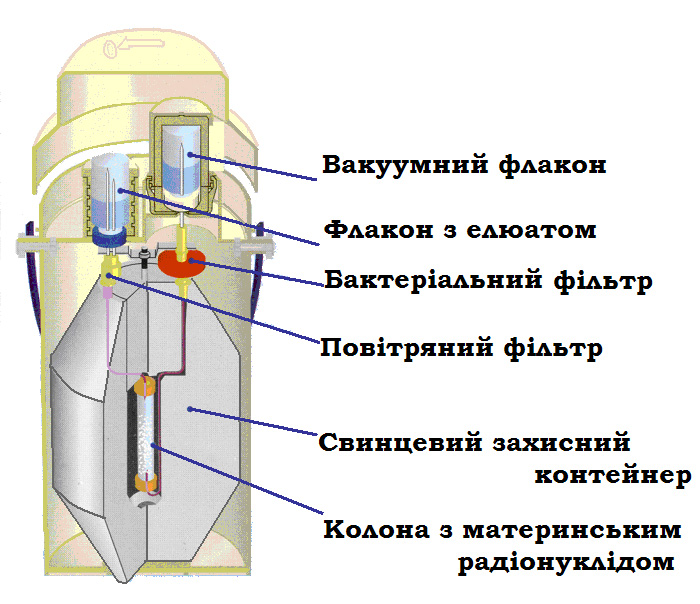 сновные
элементы генератора: защитный кожух,
колонна с материнским радионуклидом и
система коммуникаций (см. рис..3.1.).
Дочерний короткоживущий
радионуклид, что образуется в результате
распада материнского радионуклида,
вымывают из генератора. Обычно пользуются
генератором 99mТс
с периодом полураспада 6 часов
(материнский радионуклид 99Мо),
87mSr с
периодом полураспада 2,8 часа (материнский
радионуклид 87Y),
113mIn с периодом
полураспада 99,8 минуты
(материнский радионуклид 113Sn,
132I с периодом
полураспада 2,3 часа (материнский
радионуклид 132Тe)
и др.
сновные
элементы генератора: защитный кожух,
колонна с материнским радионуклидом и
система коммуникаций (см. рис..3.1.).
Дочерний короткоживущий
радионуклид, что образуется в результате
распада материнского радионуклида,
вымывают из генератора. Обычно пользуются
генератором 99mТс
с периодом полураспада 6 часов
(материнский радионуклид 99Мо),
87mSr с
периодом полураспада 2,8 часа (материнский
радионуклид 87Y),
113mIn с периодом
полураспада 99,8 минуты
(материнский радионуклид 113Sn,
132I с периодом
полураспада 2,3 часа (материнский
радионуклид 132Тe)
и др.
Рис..3.1. Схема радионуклидного генератора.
Фармацевтические требования к рфп
Химическая чистота РФП определяется наличием в нем посторонних нерадиоактивных веществ.
Радиохимическая чистота определяется частью радионуклида, который находится в РФП в необходимой химической форме. Например, если радиохимическая чистота гиппурана составляет 98%, это означает, что в препарате 98% 131I, связанного с гипураном. Радиохимические примеси могут существенно влиять на достоверность получаемой информации.
Радионуклидная чистота - часть общей активности препарата, обусловленная необходимым радионуклидом.
Апирогенность обеспечивается использованием апирогенных реагентов, растворов и соблюдением соответствующих требований процесса производства препарата.
Радиотоксичность - степень лучевого (повреждающего) действия РФП на организм. По степени радиационной безопасности радионуклиды делят на 4 группы:
• Группа А - особенно высокой радиотоксичности (в диагностике не используется);
• Группа бы - высокой радиотоксичности (131I; 89Sr);
• Группа В - средней радиотоксичности (75Se; 198Au);
• Группа Г - низкой радиотоксичности (51Cr; 67Ga;64Cu).
Введенный радионуклид в кровь сначала равномерно распределяется в организме, после чего накапливается в определенных органах и тканях. Все РФП делят на 3 группы: органотропные (99mТс пертехнат, 198Au коллоид, 197Hg промеран), туморотропные (67Ga цитрат) и без выраженного селективного накопления (24Na). Критерием, определяющим токсичность нуклида, является эффективный период полувыведения (Тэфф.).
Для регистрации РФП в организме необходимо чтобы его излучение было достаточной энергии для регистрации приборами (50-150 кеВ).
Табл.3.1. Основные характеристики РФП и лучевые нагрузки на критические органы
Радионуклид |
Т1/2 |
Соединения |
Критический орган |
Лучевая нагрузка, МЗв/МБк
|
|||||
32Р |
14,З суток (β-) |
двухзамещенный фосфат натрия |
Организм в целом Половые железы Красный костный мозг |
2,7 1,8 4,5
|
|
||||
67Ga |
3,25 суток |
цитрат |
Костный мозг |
0,15 |
|
||||
75Se |
120,4 суток |
селен-метионин |
Печень Почки |
6,2 6,2 |
|
||||
99mTc |
6 часов. |
пертехнат, пирофосфат, тетрафосмин, лимфоцис |
Печень Селезенка Половые железы Скелет |
0,092 0,057 0,0015 0,0094 |
|
||||
111In |
2,8 суток |
цитрин |
Почки Красный костный мозг |
0,016 0,0017
|
|
||||
113mIn |
100 мин. |
цитрин |
Печень Организм в целом |
0,10 0,0025 |
|
||||
131I |
8,06 суток |
йодид калию |
Щитовидная железа Половые железы Почки Организм в целом Толстая кишка Печень |
570 0,058 0,075 0,0049 9,4 0,22 |
|
||||
133Xe |
5,29 суток |
|
Легкие Половые железы |
0,011 0,00035 |
|
||||
197Hg |
64,1 час. |
промеран, меченый 197Hg |
Почки Половые железы |
3,1 0,011 |
|
||||
198Au |
2,69 суток |
коллоидное |
Печень Селезенка Красный костный мозг |
11 3,3 0,73
|
|
||||
Выбор индикатора и аппаратуры для радионуклидного исследования осуществляют в зависимости от задачи исследования.
Пути введения РФП в организм: энтеральный, внутривенный, внутриартериальный, в лимфатические сосуды, внутрикожный и подкожный, внутритканевой, в спинномозговой канал, ингаляционный.
