
- •Часть I
- •Введение
- •Номенклатура и классификация неорганических соединений Вводная часть
- •Номенклатура неорганических соединений июпак
- •Традиционные названия сложных соединений
- •Классификация неорганических веществ
- •Вопросы к семинару
- •Техника безопасности Общие правила работы в химической лаборатории
- •Общие правила работы с химическими реактивами
- •Ядовитые и вредные вещества
- •Химические ожоги
- •Меры по предупреждению пожаров, возгораний и взрывов
- •Поражение электрическим током
- •Искусственное дыхание
- •Наружный массаж сердца
- •Меры первой помощи при кровотечениях от порезов
- •Меры предосторожности при мытье посуды
- •Вопросы к семинару
- •Правила оформления отчета по лабораторным работам
- •Т ехника лабораторных работ
- •1. Работа со стеклом и пробками
- •2. Взвешивание
- •3. Определение концентрации раствора. Фильтрование
- •Вопросы к семинару
- •Эквивалент
- •Лабораторная работа «Определение мольной массы эквивалентов»
- •Вопросы к семинару
- •Способы выражения состава раствора
- •Лабораторная работа «Приготовление растворов»
- •Вопросы к семинару
- •Термохимия
- •Лабораторная работа «Определение тепловых эффектов»
- •Вопросы к семинару
- •Химическое равновесие
- •Лабораторная работа «Равновесие»
- •Вопросы к семинару
- •Скорость химических реакций
- •Лабораторная работа «Скорость химических реакций»
- •Вопросы к семинару
- •Вопросы к коллоквиуму I
- •Задачи к коллоквиуму I
- •Растворимость электролитов
- •Лабораторная работа «Растворимость и пр»
- •Вопросы к семинару
- •Электролитическая диссоциация
- •Лабораторная работа «Электролитическая диссоциация»
- •Вопросы к семинару
- •Методика решения задач
- •Гидролиз солей
- •Лабораторная работа «Гидролиз солей»
- •Вопросы к семинару
- •Коллоидные растворы
- •Лабораторная работа «Коллоидные растворы»
- •Вопросы к семинару
- •Редокс-процессы
- •Лабораторная работа «овр»
- •Вопросы к семинару
- •Электрохимия
- •Лабораторная работа «Электрохимия»
- •Ряд напряжений. Перенапряжение
- •Вопросы к семинару
- •Комплексные соединения
- •Лабораторная работа «Получение и свойства кс»
- •Вопросы к семинару
- •Вопросы к коллоквиуму II
- •Лабораторная работа «Очистка веществ»
- •Вопросы к семинару
- •Библиографический список
- •Оглавление
Вопросы к семинару
1. Определение моля и эквивалента. Как рассчитать фактор эквивалентности?
2. Закон Авогадро. Мольная масса и мольный объем вещества и его эквивалентов. Для каких соединений они имеют переменные значения? Закон эквивалентов.
3. Как найти
практически
![]() и
.
Формула Клапейрона-Менделеева.
и
.
Формула Клапейрона-Менделеева.
4. При каких условиях реальные газы можно рассматривать как идеальные?
5. Сколько атомов в моле вещества? а молекул в 100 мл воды при 40С?
6. Решить каждому студенту одну из следующих задач по [6] (№10 и №11), (с №1 по №9), (с №12 по №16).
Способы выражения состава раствора
Состав раствора выражают разными способами: в массовых, объемных или молярных долях, или указывая его молярную концентрацию и др. [8].
Массовая доля
соединения (![]() )
показывает, какую часть (т.е. долю) от
массы всей системы, состоящей из k
компонентов, составляет масса данного
вещества.
)
показывает, какую часть (т.е. долю) от
массы всей системы, состоящей из k
компонентов, составляет масса данного
вещества.
Объемная доля
соединения (![]() )
используется для газообразных систем
и равна отношению объема данного газа
к объему всей системы, состоящей из k
газов.
)
используется для газообразных систем
и равна отношению объема данного газа
к объему всей системы, состоящей из k
газов.
Молярная доля
вещества (![]() )
равна отношению количества данного
соединения к числу молей всей системы,
содержащей k компонентов.
)
равна отношению количества данного
соединения к числу молей всей системы,
содержащей k компонентов.
Доли рассчитывают по соответствующим формулам:
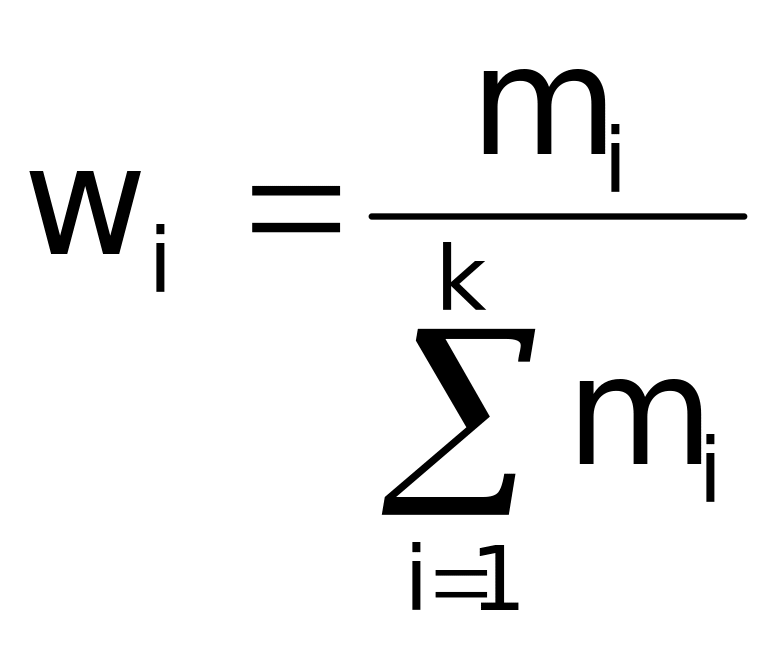 ,
,
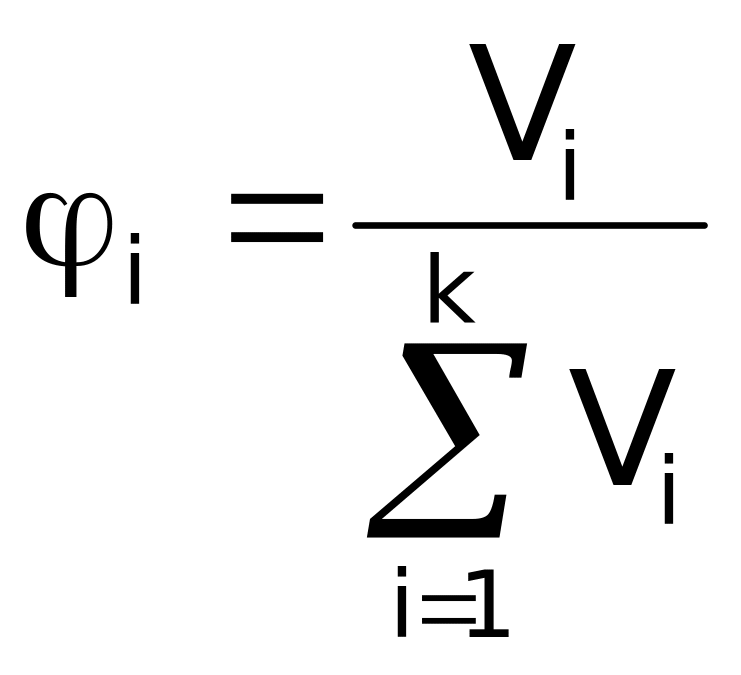 ,
,
 .
.
Молярная
концентрация показывает
количество растворенного вещества,
которое находится в 1л раствора. Ее
обозначение – C. Например,
запись
![]() моль/л
означает, что в 1 л
раствора – одна десятая моля хлороводорода;
а
моль/л
означает, что в 1 л
раствора – одна десятая моля хлороводорода;
а
![]() моль
указывает на то, что 1 л раствора содержит
1 моль эквивалентов
перманганата калия, то есть
моль
указывает на то, что 1 л раствора содержит
1 моль эквивалентов
перманганата калия, то есть
![]() или 0,2 моль его.
или 0,2 моль его.
Возможна и другая
запись молярной концентрации, например:
0,1М НСl – децимолярный
раствор; или
![]() ,
т.е.
,
т.е.
![]() – это двунормальный раствор. (Если
молярная концентрация выражена через
моли эквивалентов, то обозначается Сf
и при ее названии используется термин
«нормальная».)
– это двунормальный раствор. (Если
молярная концентрация выражена через
моли эквивалентов, то обозначается Сf
и при ее названии используется термин
«нормальная».)
Молярная концентрация
раствора, который приготовлен из навески
растворенного вещества m (г)
в мерной колбе объема V (мл),
рассчитывается по формуле:
![]() .
(Для расчета Сf
вместо М подставляют
.
(Для расчета Сf
вместо М подставляют
![]() ).
).
Рассмотрим на конкретных примерах, как осуществляется переход от одного способа выражения концентрации раствора к другому.
Пример 1.
Определить массовую долю азотной кислоты
в 12M ее растворе, плотность
которого (![]() )
равна 1,33 г/мл.
)
равна 1,33 г/мл.
Массовая
доля кислоты определяется формулой:
![]() .
.
Масса
1 л 12M
раствора кислоты равна: ![]() г;
г;
а
масса растворенного вещества: ![]() .
.
Следовательно,
![]() ,
а
,
а
![]() .
.
Пример 2.
Рассчитать молярную и нормальную
концентрации фосфорной кислоты с
массовой долей кислоты в растворе 3%
(![]() г/мл).
г/мл).
Искомые
концентрации определяются формулами:
![]() и
и
![]() .
.
Если взять 100 г раствора, указанного в задаче, то получим:
![]() ,
,
![]() .
И тогда:
.
И тогда:
![]() ,
а
,
а
![]() .
.
Лабораторная работа «Приготовление растворов»
(Приготовленные растворы обязательно сдавать препаратору!)
1. Приготовление раствора заданного состава. Определить состав концентрированной серной кислоты, имеющейся в лаборатории, с помощью ареометра и, проведя необходимые расчеты, приготовить из нее 100 мл раствора с массовой долей кислоты, указанной преподавателем. В присутствии препаратора измерить плотность полученного раствора и сравнить ее значение с представленным в табл. 8. Рассчитать ошибку определения. Чем она может быть вызвана?
2. Определение влажности воздушно-сухой соли. Исходя из точной навески дихромата калия, указанной преподавателем по таблице 9, приготовить 100 мл раствора. Измерить его плотность в присутствии препаратора и рассчитать влажность исходной соли. Пример расчета: пусть приготовили 100мл раствора из 8,7г K2Cr2O7. Его плотность – 1,0533г/мл, значит, m(раствора) = 105,53г, а (K2Cr2O7) = 7,986% (находим по табл. 8 интерполяцией). То есть m(сухой соли) =105,53г* 7,986% = 8,4276, следовательно, влажность соли: (8,7–8,4276)/8,7=3,1%.
Таблица 8. Плотность водных растворов при 180С
w, % |
H2SO4 |
K2Cr2O7 |
2 |
1,013 |
1,0122 |
4 |
1,027 |
1,0264 |
6 |
1,040 |
1,0408 |
8 |
1,055 |
1,0554 |
10 |
1,069 |
1,0703 |
12 |
1,083 |
– |
Таблица 9. Задания к определению влажности соли K2Cr2O7
№ задания |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
Навеска соли, г |
3,9 |
6,8 |
8,7 |
4,6 |
2,4 |
7,2 |
6,4 |
7,9 |
