
- •Часть I
- •Введение
- •Номенклатура и классификация неорганических соединений Вводная часть
- •Номенклатура неорганических соединений июпак
- •Традиционные названия сложных соединений
- •Классификация неорганических веществ
- •Вопросы к семинару
- •Техника безопасности Общие правила работы в химической лаборатории
- •Общие правила работы с химическими реактивами
- •Ядовитые и вредные вещества
- •Химические ожоги
- •Меры по предупреждению пожаров, возгораний и взрывов
- •Поражение электрическим током
- •Искусственное дыхание
- •Наружный массаж сердца
- •Меры первой помощи при кровотечениях от порезов
- •Меры предосторожности при мытье посуды
- •Вопросы к семинару
- •Правила оформления отчета по лабораторным работам
- •Т ехника лабораторных работ
- •1. Работа со стеклом и пробками
- •2. Взвешивание
- •3. Определение концентрации раствора. Фильтрование
- •Вопросы к семинару
- •Эквивалент
- •Лабораторная работа «Определение мольной массы эквивалентов»
- •Вопросы к семинару
- •Способы выражения состава раствора
- •Лабораторная работа «Приготовление растворов»
- •Вопросы к семинару
- •Термохимия
- •Лабораторная работа «Определение тепловых эффектов»
- •Вопросы к семинару
- •Химическое равновесие
- •Лабораторная работа «Равновесие»
- •Вопросы к семинару
- •Скорость химических реакций
- •Лабораторная работа «Скорость химических реакций»
- •Вопросы к семинару
- •Вопросы к коллоквиуму I
- •Задачи к коллоквиуму I
- •Растворимость электролитов
- •Лабораторная работа «Растворимость и пр»
- •Вопросы к семинару
- •Электролитическая диссоциация
- •Лабораторная работа «Электролитическая диссоциация»
- •Вопросы к семинару
- •Методика решения задач
- •Гидролиз солей
- •Лабораторная работа «Гидролиз солей»
- •Вопросы к семинару
- •Коллоидные растворы
- •Лабораторная работа «Коллоидные растворы»
- •Вопросы к семинару
- •Редокс-процессы
- •Лабораторная работа «овр»
- •Вопросы к семинару
- •Электрохимия
- •Лабораторная работа «Электрохимия»
- •Ряд напряжений. Перенапряжение
- •Вопросы к семинару
- •Комплексные соединения
- •Лабораторная работа «Получение и свойства кс»
- •Вопросы к семинару
- •Вопросы к коллоквиуму II
- •Лабораторная работа «Очистка веществ»
- •Вопросы к семинару
- •Библиографический список
- •Оглавление
Вопросы к семинару
1. Техника лабораторных работ со стеклом (разрезание, сгибание, оплавление, запаивание трубок, изготовление капилляров).
2. Правила подбора и сверления пробок.
3. Химическая посуда, указать назначение каждой. Мытье химической посуды. Как проверить ее чистоту?
4. Какую посуду называют мерной, а какую – измерительной? Правила работы с нею. Устройство и назначение промывалки.
5. Схема конструкции лабораторных весов. Правила взвешивания.
6. Какое физическое свойство в жидкостных термометрах используется при определении температуры? Какие жидкости, кроме ртути, можно применять для этой цели?
7. Ареометры. Их назначение, точность определения с помощью денсиметра. Правила пользования ареометром.
8. Различные способы отделения осадка от раствора: фильтрование (для чего используют складчатый фильтр?), декантация, центрифугирование. Указать недостатки и преимущества каждого. Что такое центрифугат, фильтрат? Виды фильтров. Фильтрование с обогревом, под вакуумом. Как провести фильтрование, если имеется всего 3 капли мутного раствора?
Эквивалент
Эквивалентом
вещества в реакциях
обмена называется его
реальная
частица (атом, ион, молекула) или условная
(нереальная) частица (доля атома, иона,
молекулы), которая равноценна иону
.
Реальные частицы – это, в частности,
однозарядные ионы
![]() ,
,
и т.п., а условная – например, треть
молекулы фосфорной кислоты
,
,
и т.п., а условная – например, треть
молекулы фосфорной кислоты
![]() (т.е. ее фактор эквивалентности (f)
равен 1/3) [8].
(т.е. ее фактор эквивалентности (f)
равен 1/3) [8].
В окислительно-восстановительных реакциях (ОВР) эквивалент – это частица вещества, участвующая в передаче 1 электрона (е):
![]() или
или ![]() .
.
Данные
частицы – реальные;
а условной
в ОВР является, например,
![]() при осуществлении процесса в нейтральной
среде. (В этих условиях перманганат-ион
принимает 3 электрона, следовательно,
1 е присоединяется к
1/3 данного аниона, т.е.
при осуществлении процесса в нейтральной
среде. (В этих условиях перманганат-ион
принимает 3 электрона, следовательно,
1 е присоединяется к
1/3 данного аниона, т.е.
![]() [8]). Мольная масса эквивалентов вещества
рассчитывается по формуле:
[8]). Мольная масса эквивалентов вещества
рассчитывается по формуле:
![]() ,
и может быть определена экспериментально,
как описано ниже.
,
и может быть определена экспериментально,
как описано ниже.
Лабораторная работа «Определение мольной массы эквивалентов»
С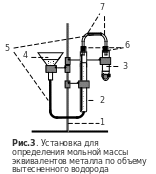 обрать
установку (рис. 3). Она
состоит из штатива (1),
на котором крепятся бюретка на 50 мл (2),
реакционная пробирка (3)1
и стеклянная воронка (4),
соединенные между собой резиновыми
шлангами (5), пробками
с отверстиями (6) и
стеклянными трубками (7).
обрать
установку (рис. 3). Она
состоит из штатива (1),
на котором крепятся бюретка на 50 мл (2),
реакционная пробирка (3)1
и стеклянная воронка (4),
соединенные между собой резиновыми
шлангами (5), пробками
с отверстиями (6) и
стеклянными трубками (7).
Бюретку укрепить на штативе так, чтобы нулевое деление оказалось на уровне глаз наблюдателя. Не присоединяя пробирку, заполнить установку (через воронку) водой. Уровень ее в бюретке должен быть на нулевом делении, а в воронке – находиться в средней ее части.
Проверить установку на герметичность. Для этого присоединить пробирку и опустить воронку вниз на 15–20 см. Уровень воды в бюретке несколько опустится и останется постоянным (если установка негерметична, то уровень воды в бюретке будет непрерывно опускаться, приближаясь к уровню воды в воронке).
После проверки герметичности отсоединить пробирку, на дно ее поместить взвешенную (с точностью до 0,001г) навеску исследуемого металла (около 0,02 г Zn или 0,009 г Mg или Al). Затем быстро, чтобы избежать потерь водорода, прилить двукратный избыток 1М H2SO4 к навеске цинка или магния, а в случае алюминия – 10% щелочь и сразу же плотно присоединить пробирку к установке.
Взаимодействие кислоты с цинком идет при комнатной температуре, а с железом требует нагрева (для чего погружают реакционный сосуд в стакан с горячей водой). Реакцию алюминия со щелочью следует ускорить нагреванием в конце опыта.
Водород, выделяющийся в результате взаимодействия металла с раствором кислоты или щелочи, вытесняет из бюретки воду. Воронку при этом надо опускать и стараться держать воду в ней и в бюретке на одном уровне, чтобы давление газа внутри установки было все время близким атмосферному.
Когда весь металл растворится, прекратится и понижение уровня воды в бюретке, однако окончательный отсчет показаний делается лишь после того, как пробирка охладится до комнатной температуры, и только после приведения к одному уровню жидкости в бюретке и в воронке.
Записать в отчет массу металла – m, г; объем вытесненного газа в условиях опыта – V, мл; температуру опыта – t, 0C; давление по барометру – p, атм.; давление насыщенного пара воды при температуре опыта – h, мм рт.ст. (см. табл. 7).
Таблица 7. Зависимость давления водяного пара (в миллиметрах рт.ст.) от t (0С)
Температура |
Давление |
Температура |
Давление |
Температура |
Давление |
1 |
4,93 |
11 |
9,84 |
21 |
18,65 |
2 |
5,29 |
12 |
10,52 |
22 |
19,83 |
3 |
5,68 |
13 |
11,23 |
23 |
21,07 |
4 |
6,10 |
14 |
11,99 |
24 |
22,38 |
5 |
6,54 |
15 |
12,79 |
25 |
23,76 |
6 |
7,01 |
16 |
13,63 |
26 |
25,21 |
7 |
7,51 |
17 |
14,53 |
27 |
26,74 |
8 |
8,05 |
18 |
15,48 |
28 |
28,35 |
9 |
8,61 |
19 |
16,48 |
29 |
30,04 |
10 |
9,21 |
20 |
17,54 |
30 |
31,82 |
Привести объем выделившегося водорода к нормальным условиям (н.у.), при этом надо учесть, что общее давление газа в бюретке, равное атмосферному р, складывается из парциальных давлений водорода и водяного пара. Таким образом, объем водорода при н.у. определяется по формуле1:
![]() .
.
Затем
рассчитать мольную массу эквивалентов
металла, соответствующую 1,008 г
водорода (по объему – 11 200 мл
),
используя равенство:
![]() .
.
Опыт
провести два раза, величину
![]() найти как среднее из двух определений.
Сравнить полученное ее значение с
рассчитанным по формуле:
и оценить абсолютную и относительную
ошибку эксперимента. Чем она обусловлена?
найти как среднее из двух определений.
Сравнить полученное ее значение с
рассчитанным по формуле:
и оценить абсолютную и относительную
ошибку эксперимента. Чем она обусловлена?
