
- •I. Основные понятия и законы химии
- •II. Строение атома
- •1. Ядерная модель атома. Строение атома. Состав атомных ядер. Массовое число. Атомный номер. Нуклид. Изотопы. Явление радиоактивности. Воздействие радиоактивного излучения на живую материю.
- •III. Периодический закон и периодическая система элементов д.И.Менделеева
- •IV. Химическая связь и строение вещества
- •Поскольку в этой молекуле оба атома кислорода равноценны (и, следовательно, равноценны обе связи s—o), свойства молекулы лучше передает графическая формула с делокализованной π-связью:
- •6. Ионная и металлическая связь. Механизм образования ионной связи. Степень ионности связи. Ионные кристаллические решетки. Координационное число иона.
- •9. Молекулярное и немолекулярное строение веществ. Молекулярные, атомные и ионные соединения. Графические и структурные формулы веществ. Газообразное и конденсированное состояния веществ.
- •V. Химическая кинетика и термодинамика
- •VI. Растворы
- •VII. Окислительно-восстановительные реакции (овр)
- •2. Овр внутримолекулярного типа.
- •Электродвижущая сила (эдс) гальванического элемента
- •1. Оценить окислительно-восстановительные свойства веществ.
- •2. Предсказать принципиальную возможность осуществления реакции в указанном направлении.
- •4. Выбрать наиболее вероятную реакцию из нескольких возможных.
- •5. Рассчитать значение константы химического равновесия данной реакции.
- •6. Оценить влияние различных факторов на направление протекания окислительно-восстановительных реакций
- •4 . Коррозия металлов. Основные виды коррозии металлов. Методы защиты металлов от коррозии.
- •VIII. Комплексные соединения
- •IX. Водород и элементы группы viia
- •Простые вещества
- •Водород
- •Галогены и их соединения
- •Бинарные соединения галогенов
- •3. Соединения с другими неметаллами.
- •Многоэлементные соединения галогенов
- •Взаимосвязь важнейших соединений хлора:
- •X. Элементы группы via
- •Взаимосвязь важнейших соединений серы
- •XI. Элементы группы va
- •В заимосвязь важнейших соединений азота:
- •В заимосвязь важнейших соединений фосфора:
- •Хii. Элементы группы IV а
- •В заимосвязь важнейших соединений кремния
- •В заимосвязь важнейших соединений углерода
- •XIII. Металлы
- •Металлы главных подгрупп
- •Взаимосвязь важнейших соединений натрия
- •Взаимосвязь важнейших соединений кальция
- •Взаимосвязь важнейших соединений алюминия
- •4. Подгруппа германия. Общая характеристика элементов. Сопоставление их физических и химических свойств со свойствами углерода и кремния.
- •Переходные металлы
- •Взаимосвязь важнейших соединений хрома
- •Взаимосвязь важнейших соединений марганца
- •Взаимосвязь важнейших соединений железа
- •Взаимосвязь важнейших соединений меди
- •Министерство образования республики Беларусь белорусский государственный университет
- •«Общая и неорганическая химия»
В заимосвязь важнейших соединений азота:
N2 + 3H2
 NH3;
NH3;NH3
 N2
+ H2;
N2
+ H2;NH3 + O2
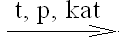 NO + H2O;
NO + H2O;NO + H2 NH3 + H2O;
NH3 + HNO2 (охл.р-р) → NH4NO2;
NH4NO2 + KOH NH3 + H2O + KNO2;
NH4NO2 N2 + H2O;
N2 + O2 NO;
NH3 + HNO3 → NH4NO3;
NH4NO3 + KOH NH3 + H2O + KNO3;
NH4NO3 N2O + H2O;
N2O N2 + O2;
NH4NO2 + Br2 + H2O → NH4NO3 + HBr;
NO + KMnO4 + H2SO4 → HNO3 + MnSO4 + K2SO4 + H2O;
HNO3(разб.) + Cu NO + Cu(NO3)2 + H2O;
HNO3(конц..) + Cu → NO2 + Cu(NO3)2 + H2O;
NO2 + O2 + H2O → HNO3;
NO2
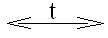 NO + O2;
NO + O2;NO + O2 → NO2;
NO2 + H2O
 HNO2
+ HNO3;
HNO2
+ HNO3;HNO2(р-р) NO2 + NO↑ + H2O;
NO2 + NO N2O3;
N2O3 NO2 + NO;
N2O3 + H2O → HNO2;
N2O3 + H2O + NH3 → NH4NO2;
См. № 22;
См. № 23;
См. № 21;
HNO2 + Na[AlH4] + H2O → NH3↑ + Na[Al(OH)4];
HNO3 + P2O5
 N2O5↑
+ HPO3;
N2O5↑
+ HPO3;N2O5 + H2O → HNO3;
N2O5 NO2 + O2;
NO2 + O3 → N2O5 + O2;
N2O3 + O3 → N2O5 + O2;
N2O5 + CuO → Cu(NO3)2;
Cu(NO3)2 NO2 + CuO + O2;
Cu(NO3)2 + H2SO4(конц.) HNO3↑+ CuSO4;
HNO3 + KOH → KNO3 + H2O;
KNO3 KNO2 + O2;
KNO2(охл.) + HCl(охл..) → HNO2 + KCl;
HNO2 + NH3 → NH4NO2;
N2O3 + KOH → KNO2 + H2O;
HNO2 + KOH → KNO2 + H2O;
KNO2 + Cl2 + H2O → KNO3 + HCl;
NH3 + HNO3 → NH4NO3;
NH4NO3 + H2SO4(конц.) HNO3↑ + NH4HSO4;
NH4NO3 + Ba(OH)2 NH3↑ + Ba(NO3)2;
Ba(NO3)2 + (NH4)2CO3 → BaCO3↓ + NH4NO3.
В заимосвязь важнейших соединений фосфора:
P4 + O2 (изб.)
 P2O5;
P2O5;P2O5 + C P4 + CO;
P4 + Ba(OH)2 + H2O PH3 + Ba(H2PO2)2;
PH3 P4 + H2;
P4 + Ca Ca3P2;
Ca3P2 + HCl → PH3 + CaCl2;
PH3 + O2 (изб.) P2O5 + H2O;
P2O5 + Ca Ca3P2 + Ca3(PO4)2;
P4 + O2 (нед.) P2O3;
P2O3 P4 + P2O5;
См. № 3;
Ba(H2PO2)2 PH3 + BaHPO4;
PH3 + O2 (нед.) P2O3 + H2O;
P2O3 + H2O (охл.) → H3PO3;
H3PO3 PH3 + H3PO4;
Ba(H2PO2)2 + H2SO4 → H3PO2 + BaSO4;
H3PO2 + Ba(OH)2 → Ba(H2PO2)2 + H2O;
H3PO2
 PH3
+ H3PO3;
PH3
+ H3PO3;Cм. № 18;
P2O3 + O2 P2O5;
P2O5 + H2O (охл.) → HPO3;
HPO3 + H2O H4P2O7;
H4P2O7 + H2O H3PO4;
H3PO4 (распл.) H4P2O7 + H2O;
H4P2O7 + Ca(OH)2 → Ca2P2O7 + H2O;
Ca2P2O7 + H2SO4 → H4P2O7 + CaSO4;
Ca2P2O7 + SiO2 P2O5↑ + CaSiO3;
P2O5 + CaO Ca2P2O7;
Ca2P2O7 + H2O
 CaHPO4;
CaHPO4;CaHPO4 Ca2P2O7 + H2O;
CaHPO4 + Ca(OH)2 → Ca3(PO4)2 + H2O;
Ca3(PO4)2 + H3PO4 → CaHPO4;
Ca3(PO4)2 + SiO2 P2O5↑ + CaSiO3;
P2O5 + CaO Ca3(PO4)2;
Ca3(PO4)2 + H2SO4 → H3PO4 + CaSO4;
H3PO4 + Ca(OH)2 → Ca3(PO4)2 + H2O;
Ca3(PO4)2 + H3PO4 → Ca(H2PO4)2;
Ca(H2PO4)2 + Ca(OH)2 → Ca3(PO4)2 + H2O;
Ca(H2PO4)2 + Ca(OH)2 → CaHPO4 + H2O;
CaHPO4 + H3PO4 → Ca(H2PO4)2;
H3PO4 + Ca(OH)2 → Ca(H2PO4)2 + H2O;
Ca(H2PO4)2 + H2SO4 → H3PO4 + CaSO4;
Ca(H2PO4)2 Ca(PO3)2 + H2O;
Ca(PO3)2 + H2O
 Ca(H2PO4)2;
Ca(H2PO4)2;Ca(PO3)2 + SiO2 P2O5↑ + CaSiO3;
P2O5 + CaO Ca(PO3)2;
Ca(PO3)2 + H2SO4 (охл.) → HPO3 + CaSO4;
HPO3 + Ca(OH)2 → Ca(PO3)2 + H2O;
Ca(PO3)2 + SiO2 + С P4↑ + CaSiO3 + CO;
Ca2P2O7 + SiO2 + С P4↑ + CaSiO3 + CO;
P2O5 + H2O
 H3PO4;
H3PO4;CaHPO4 + H2SO4 → H3PO4 + CaSO4;
H3PO4 + Ca(OH)2 → CaHPO4 + H2O;
H3PO2
 H3PO4
+ PH3;
H3PO4
+ PH3;H3PO3 H3PO4 + PH3;
Ca3(PO4)2 + SiO2 + С P4↑ + CaSiO3 + CO;
