
- •Практические работы Работа 1
- •Реагенты
- •Реагенты
- •Работа 3 Определение фосфора в виде фосфорномолнбденовой сини
- •Реагенты
- •Работа 4 Определение марганца формальдоксимом
- •Реагенты
- •Работа 5 Определение титана в виде пероксидного комплекса
- •Реагенты
- •Работа 6 Определение хрома дифенилкарбазидом
- •Аппаратура и реактивы
- •Выполнение работы.
Работа 5 Определение титана в виде пероксидного комплекса
Титан (IV) образует с пероксидом водорода в кислой среде желтый комплекс состава [Ti(OH)2H2O]2+. Устойчивость комплекса невелика (1104), поэтому для полноты его образования требуется значительный избыток пероксида водорода. Наиболее подходящей средой для реакции титана с пероксидом водорода являются сернокислые растворы (0,5-1 Μ H2SO4).
Пероксидная методика обладает малой чувствительностью (max=7,0102 при max=410 нм), но широко используется в практике молекулярного абсорбционного анализа. Ее с успехом применяют для определения титана в сталях, чугунах, тантале, жаропрочных сплавах, ильменитовых концентратах, железных рудах и т. д.
Мешают определению титана фосфаты, фториды, оксалаты и цитраты, связывающие его в комплексы, а также ионы металлов, обладающие собственной окраской или образующие пероксидные комплексы (V, Mo, U, Nb, Cr).
Реагенты
Стандартный раствор титана (IV), 0,5 мг/мл.
Пероксид водорода, 3%-ный раствор.
Серная кислота, 5%-ный раствор.
Выполнение определения. В пять мерных колб вместимостью 50,0 мл вводят стандартный раствор титана с содержанием (мг): 0,5; 1,0; 1,5; 2,0; 2,5 соответственно, 20 мл воды, 5 мл раствора серной кислоты, 3 мл раствора пероксида водорода. Содержимое колб разбавляют водой до метки. Растворы фотометрируют относительно воды и строят градуировочный график.
Для определения титана в анализируемом растворе аликвоту этого раствора помещают в мерную колбу вместимостью 50,0 мл. С раствором проводят те же операции и в той же последовательности, что и при приготовлении растворов, используемых для градуировки, а затем фотометрируют относительно воды. Содержание титана находят по градуировочному графику.
Работа 6 Определение хрома дифенилкарбазидом
Дифенилкарбазид в кислой среде взаимодействует с хромом (VI) с образованием растворимого соединения красно-фиолетового цвета. В спектре поглощения продукта реакции наблюдается интенсивная полоса с max=546 нм и max=4,2104.
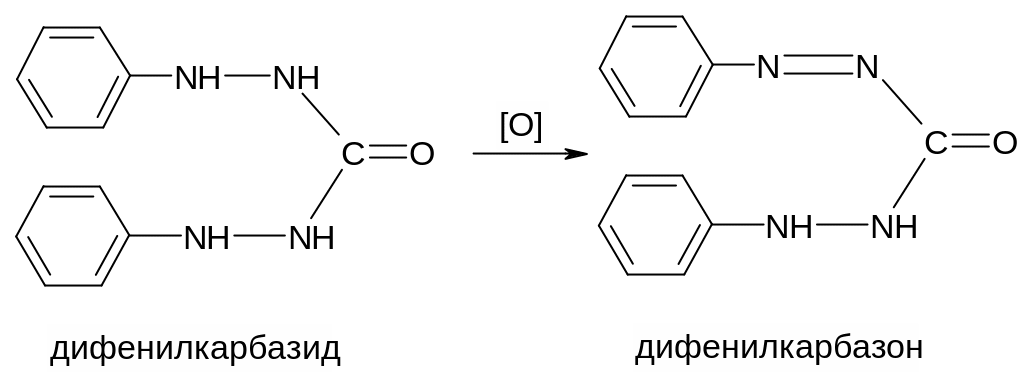
Эту фотометрическую реакцию изучали неоднократно, однако механизм ее до конца не выяснен. Предполагают, что сначала дихромат-ион окисляет дифенилкарбазид до дифенилкарбазона:
Работа № 7. Определение меди в виде аммиаката
При действии избытка аммиака на раствор соли меди появляется интенсивное синее окрашивание, вызываемое образованием комплексных ионов:
Сu2+ + 4NНз = [Сu(NНз)4]2+.
Аппаратура и реактивы
Фотоэлектроколориметр любой марки.
Стандартный раствор сульфата меди, содержащий 1 мг Сu в 1 мл.
Аммиак, раствор 5% (масс.).
Мерные колбы вместимостью 100 мл, бюретки, мерные цилиндры.
Выполнение работы.
Построение градуировочного графика. В 6 мерных колб вместимостью 100 мл наливают из бюретки соответственно 1, 3, 5, 7, 9, 10 мл стандартного раствора СuSO4. В каждую колбу добавляют по 25 мл раствора аммиака и доводят до метки дистиллированной водой. Измеряют оптическую плотность А растворов 3 раза при выбранном светофильтре в кювете с выбранной толщиной слоя, вычисляют Aср и строят градуировочный график.
Определение содержания меди в растворе неизвестной концентрации. Раствор соли меди неизвестной концентрации обрабатывают как описано выше. Измеряют оптическую плотность и находят по градуировочному графику содержание меди в исследуемом растворе.
