
Korrozia_i_zaschita_metallov-2015_1
.pdfР А Б О Т А 6. Исследование влияния анодной поляризации на
защиту металлов и сплавов от коррозии в агрессивных средах
Т е о р е т и ч е с к о е в в е д е н и е. Анодная защита металлических
конструкций внешним током
Анодная защита внешним током (анодной поляризацией) основана на важном явлении пассивации металлов. Резкое уменьшение скорости разрушения металлов (сплавов), вызванное торможением анодного проC цесса электрохимической коррозии при воздействии сильных окислителей или при значительной анодной поляризации, называют пассивацией, а состояние металла (сплава) пассивным.
Признаки наступления пассивного состояния:
C резкое уменьшение скорости коррозии (на несколько порядков),
%смещение потенциала металла (сплава) в электроположительную сторону (например, для железа от значений: (C0,5 ÷ C0,2)В к значениям (+0,5 ÷ +1,0)В, для хрома от значений: (C0,6÷ C0,4)В до значения +0,9В),
%контроль коррозионного процесса анодной составляющей:
СА > СК , |
(6.1) |
где СА и СК C степень анодного и катодного контроля, соответственно, % (см. формулы: 2.15, 2,16).
Пассивация металла (сплава) достигается либо воздействием сильных окислителей C пассиваторов (НNO3; NaNO3; NaNO2; Na2WO4, K2Cr2О7, K2СrО4; О2), либо анодной поляризацией (от внешнего источника постоянC ного тока или вследствие контакта с более электроположительным металC лом). Некоторые металлы находятся в пассивном (или близком к пассивC ному) состоянии даже в таких слабых окислителях как вода (Al, Ti, Mg и др.), что дает возможность широко использовать их в качестве конструкC ционных материалов. Существует ряд теорий, объясняющих причину пеC рехода металлов (сплавов) в пассивное состояние. Рассмотрим наиболее обоснованные и признанные концепции.
Пленочная теория пассивности
В формировании и разработке пленочной теории пассивности приниC мали участие М. Фарадей, Ю.Р.Эванс, В.А. Кистяковский, Г.В. Акимов, Н.А. Изгарышев, П.Д. Данков, А.М. Сухотин, К. Бонхоффер, Тронстед, В.П. Батраков и др.. Авторы рассматриваемой концепции связывали пасC
70
сивное состояние металла с образованием тончайшей (порядка нескольких десятков или сотен ангстрем), часто невидимой защитной (экранирующей корродирующую поверхность) пленки продуктов взаимодействия металC лов с окислителями. Подтверждением такой точки зрения на механизм пассивности явилось то, что на многих металлах, пребывающих в пассивC ном состоянии, были обнаружены пленки, структура которых отличалась от структуры металлов. Толщина обнаруженных фаз соответствовала неC скольким молекулярным слоям (например, оптическими методами устаC новлено, что в азотной кислоте на углеродистой стали толщина пленки соC ставляет (90÷110)Ǻ; на мягкой стали (0,04%С) C (25÷30)Ǻ, на хромоникеC левой стали C (9÷10)Ǻ. Защитная пленка на алюминии, в зависимости от условий, имеет различную толщину от 50 до 1000 Ǻ).
В основном защитные пленки состоят из оксидов металлов или их смесей (например, в случае железоуглеродистых сталей – это γCFe2O3 или Fe3O4; в случае хрома C Сr2O3, СгО2; на стали, легированной хромом, C смесь оксидов железа и хрома; на алюминии C Аl2О3). Такие пленки обраC зуются в качестве первичного нерастворимого продукта анодной реакции
поверхности корродирующего металла по реакциям: |
|
mMe + mnOHC → MemOmn/2 + (mn/2) H2O |
(6.2) |
mMe + (mn/2) H2O → MenOmn/2 + mnH+ + mne |
(6.3) |
При исследовании свойств оксидных пленок установлено, что они могут быть сплошными и пористыми.
Сплошные пленки (на Аl, Тa, Nb, Zг и др.) имеют аморфную структуру и высокое электрическое сопротивление.
Пористые пленки (на Zn, Сd, Mg и др.) имеют кристаллическую структуру и малое электрическое сопротивление. Иногда могут образоC вываться пленки, состоящие из плотного со стороны металла и пористого со стороны электролита слоев (оксидные пленки, образующиеся на алюC минии в растворах серной кислоты).
Наилучшую защиту обеспечивают сплошные пленки. Для формиC рования такой оксидной пленки требуется выполнение условия сплошно% сти, сформулированного Н. Б. Пиллингом, Р. Э. Бедворсом и И. Н. ФранC цевичем. Оно состоит в том, что молекулярный объем оксида, возникаюC щего из металла и кислорода, должен быть больше объема металла, израсC ходованного на образование молекулы оксида. Считается, что пленка моC жет быть сплошной, если выполняется соотношение:
71
2,5 > GGок > 1. |
(6.4) |
Если известен состав оксидной пленки, то отношение объемов оксида |
|
и металла может быть рассчитано по уравнению: |
|
GGок = ∙ок∙J∙Jок, |
(6.5) |
где Мок C молекулярная масса оксида;
АMe C атомная масса металла (Приложение 3); ρок C плотность оксида (Приложение 12);
ρМе C плотность металла; (Приложение 12) m C число атомов металла в молекуле оксида.
Другое важное условие C достаточная однородность пленки и хо% рошая адгезия к металлу. В.А. Кистяковский считал, что это условие выC полняется, если оксид образуется в частично гидратированной форме и имеет коллоидную структуру.
Иногда первопричиной пассивности могут быть не оксидные пленки, а другие нерастворимые химические соединения: сульфаты, фосфаты, хроматы и т.д. В этом случае говорят о солевой пассивности. Так в конC центрированной серной кислоте на поверхности мягкой (0,04 %С) и углеC родистой сталей могут, в зависимости от величины потенциала и темпераC туры, образовываться такие соединения, как FeSО4·H2O, FeSО4·4H2O, FeSО4·7H2O или Fe2(SO4)3·H2О.
Анодная поляризация свинца в растворах серной кислоты также выC зывает солевую пассивность вследствие образования пленки сульфата свинца PbSO4, который в дальнейшем окисляется до диоксида РbО2, форC мирующего фазовую пленку толщиной несколько микронов.
Адсорбционная теория пассивности
Согласно адсорбционной теории, причиной пассивности является возC никновение на металлической поверхности мономолекулярного адсорбциC онного слоя кислорода (иногда другого окислителя или вещества), сплошь заполняющего поверхность или наиболее активные ее участки.
Допустив, что переход в пассивное состояние обусловлен возникноC вением при определенных потенциалах кислородных адсорбционных обC разований, можно схематически записать процесс пассивации следующим образом:
mMe + mn/4O2 → Mem|( Omn/2)адс , |
(6.6) |
72
mMe + mnOHC → Mem|(Omn/2)адс+ (mn/2) H2O + mne |
(6.7) |
mMe + (mn/2) H2O → Mem|(Omn/2)адс + mnH+ + mne. |
(6.8) |
Адсорбционная концепция пассивности имеет две принципиально отличающиеся точки зрения, объясняющие возникновение устойчивости металла.
Согласно химической точки зрения, адсорбированный кислород насыщает валентности всех (по Тамману, Ленгмюру) или наиболее активC ных (по Странскому) поверхностных атомов металла и тем самым снижает его химическую активность.
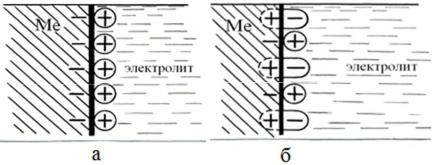
Защитное действие кислорода, адсорбированного даже на отдельных участках поверхности металла, с электрохимической точки зрения (А.Н. Фрумкин, Б.В. Эршлер, Б.Н. Кабанов, Я.М. Колотыркин) связано с изменеC нием строения двойного электрического слоя (ДЭС). При адсорбции кисC лорода на поверхности металла часть атомов кислорода ионизируется электронами металла. Связь кислорода с металлом имеет при этом дипольC ный характер, при котором адсорбированный, ионизированный кислород является отрицательным концом диполя, расположенным со стороны элекC тролита (рис. 6.1). Вследствие этого заметно уменьшается плотность поC ложительных зарядов в растворе, что в свою очередь приводит к падению концентрации электронов у поверхности металла, повышению работы выC хода электрона, а следовательно, и смещению электродного потенциала в область
Рис. 6.1. Схема двойного электрического слоя без адсорбции (а) и при адсорбции кислорода (б);  C катион;
C катион;  C адсорбированный ионизированный кислород
C адсорбированный ионизированный кислород
электроположительных значений. Таким образом, образующийся адC сорбционноCионный ДЭС (рис. 6.1,б) вместо ионного ДЭС (рис. 6.1,а) соC здает положительную разность потенциалов между металлом (сплавом) и
73
электролитом и затрудняет процесс ионизации металла. Пленочная и ад% сорбционная теории не исключают, а дополняют друг друга. Сочетание этих двух теорий позволяет наиболее полно объяснить явление пассивноC сти металлов и сплавов, особенно в тех случаях, когда фазовые пленки имеют поры.
Так, Г.В. Акимовым и В.П. Батраковым предложена гипотеза пле% ночно%адсорбционной природы пассивности нержавеющих сталей. СоC гласно этой гипотезы, на поверхности нержавеющих сталей имеется тонC кая эластичная оксидная пленка. Она обладает электронной проводимоC стью, вследствие чего диффузия анионов и катионов через неё затруднена, т.е. пленка является защитной. Под пленкой и в порах находятся атомы или ионы кислорода (или более сложные комплексы окислителя), хемоC сорбированные металлом. Наличие фазового и адсорбционного защит%
ных слоев и обеспечивает устойчивость нержавеющих сталей.
При исследовании границ пребывания металлов (сплавов) в пассивC ном состоянии было обнаружено, что при определенных условиях возC можно нарушение пассивности. Это явление было названо активацией или депассивацией, а вещества и процессы, вызывающие его, C актива% торами или депассиваторами. Активаторами могут быть восстановитеC ли (Н2, Na2SO3, Na2S2O3 и др.), комплексообразователи (NH3, CNC и др.), ионы водорода и другие вещества, способные стимулировать разрушение пассивирующего слоя на металле (сплаве). Активными депассиваторами являются ионы галоидов ClC, BrC, IC. В результате воздействия этих анионов металл (сплав) разъедается неравномерно. Почти вся поверхность металла (во всяком случае, большая доля её) остаётся пассивной, но в отдельных точках происходит глубокое разрушение – питтинг. Такой вид коррозии очень опасен. Типичным примером питтинга может служить коррозия хромистых и хромоникелевых аустенитных нержавеющих сталей в расC творах, содержащих анионы ClC. Механизм депассивации анионами га% логенов объясняется адсорбцией их на активных участках поверхности (участках, имеющих определённый потенциал), приводящей к вытеснению хемосорбированного или входящего в состав оксидной пленки кислорода и активации процесса коррозии:
Mem/(Omn/2)адс +mnGC→m[Me|(GnC)адс]+(mn/4)O2→mMen++mnGC+(mn/4)O2 (6.9)
Mem/Omn/2 + mnGC → mMeGn + (mn/2)O2 → mMen+ + mnGC + (mn/4)O2 (6.10)
74
Помимо воздействия перечисленных депассиваторов причиной расC творения пассивного металла (сплава) может быть механическое повреC ждение оксидной пленки. Сдвиг потенциала в отрицательную сторону (каC тодная поляризация) также может привести к разрушению пленки, десорбC ции кислорода и к переходу металла в активное состояние.
Устойчивость пассивного состояния металла (сплава) часто огра% ничивается определенной концентрацией окислителя или величиной анодной поляризации.
Депассивация металла (сплава), вызванная чрезмерным окислиC тельным воздействием коррозионной среды или значительной анодной поC ляризацией, называется перепассивацией или транспассивностью. ПеC репассивация наблюдается у мягких сталей (С ≈ 0,04%) в растворах азотC ной кислоты с концентрацией более 94%, у низколегированных сталей при концентрации НNO3 более 80%. Нержавеющие стали находятся в трансC пассивном состоянии в 30% НNO3 с добавками К2Сr2О7 при температурах более 50°С.
Перепассивация имеет место при значительной анодной поляризации никеля в растворах сульфата калия, хрома, никеля, а хромистых и хро% моникелевых сталей C в растворах серной кислоты.
Пленочная теория пассивности связывает транспассивное состояC ние с тем, что при значительных концентрациях окислителя и чрезмерной анодной поляризации пленка фазового оксида окисляется до хорошо расC творимых соединений, в которых металл находится в высшей степени окисления (высшие значения валентности). Например, оксиды Cr2O3 или CrO2, защищающие хром, окисляются до CrO3, образующего Сr2O72− C в
кислых растворах или СrO24− C в щелочных. При перепассивации железа и никеля образуются анионы FeO24− и NiO−2 , соответственно. И т.д.
Значительно труднее объяснить транспассивность, исходя из ад% сорбционных представлений. В этом случае приходится предположить, что по мере возрастания потенциала адсорбция кислорода становится все более сильной и несколько атомов кислорода связываются с одним атомом металла, окружая его. Это приводит к нарушению связи атомов металла с кристаллической решеткой и образованию таких кислородных комплексов, которые хорошо растворимы и содержат металл в высокой степени окисC ления.
75
По существу оба объяснения равноценны или же очень близки. Чтобы выяснить механизм перепассивации в каждом конкретном случае, требуC ются исследования.
Иногда при взаимодействии продуктов растворения металла в трансC пассивном состоянии с электролитом образуются новые труднораствориC мые соединения, при этом имеет место вторичная пассивация.
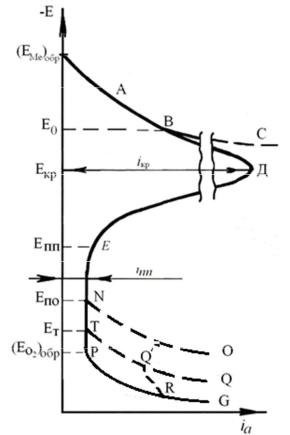
Для знакомства с кинетикой перехода металла (сплава) в пассив% ное состояние, а также выявления основных пассивационных характериC стик, имеющих практическое значение, необходимо рассмотреть анодную поляризационную кривую в условиях пассивирования. Обобщенная схема такой поляризационной кривой приведена на рис. 6.2.
Рис. 6.2. Обобщенная схема анодной потенциостатической кривой для пассивиC рующейся металлической системы
Кривая (ЕМе)обрАВС соответствует зависимости Е = f(ia) при раствореC
нии металла в активном состоянии (тафелевский участок) по реакции: |
|
Ме + mН2О Меn+ · mН2О + nе |
(2.1) |
76
Если металл (сплав) способен пассивироваться, то по достижении потенциала ЕО, отвечающего точке В, начинается адсорбция кислорода (реакции (6.6) ÷ (6.8)) или образование защитной пленки согласно реакциC ям(6.9) и (6.10). Это приводит к дополнительной поляризации процесса и отклонению поляризационной кривой от её обычного хода при активном растворении металла. В точке Д при потенциале начала видимой пассиваC ции создаются условия, когда скорость разрушения возникающего защитC ного слоя становится равной скорости его образования и достигается криC тический (предельный) ток iкр.
При потенциалах электроположительнее Екр, скорость образования защитного слоя превышает скорость его растворения, что способствует формированию пленки (адсорбционного слоя) и аномальному уменьшеC нию скорости разрушения металла iа при дальнейшей его поляризации.
Процесс формирования защитной пленки завершается в точке Е при
потенциале полной пассивации Епп. Потенциал полной пассивации чаC сто называют фладе%потенциалом Еф или потенциалом активации Еакт
(при обратном ходе анодной поляризации от положительных значений при этом потенциале происходит активирование металла).
Величина Епп (Еф, Еакт) зависит от рН среды. Для мягкой стали (0,04%С) эта зависимость описывается уравнением
Епп = 0,58 0,058рН. |
(6.11) |
Начиная с точки Е, скорость анодного процесса iпп на электроде не заC висит от потенциала, а определяется, согласно пленочной теории пассивC ности, в основном, скоростью химического растворения защитной пленки
вэлектролите не зависящей от потенциала.
Вотсутствие депассивации по достижении значения обратимого поC тенциала кислородного электрода ЕО2 обр в водных растворах начинается
электролитическое выделение кислорода (кривая РRG) |
|
2Н2О = О2 + 4Н+ + 4е |
(6.12) |
4ОНC = О2↑ + 2Н2О +4е. |
(6.13) |
Если в растворе электролита имеются активные ионы галоидов, на ряC де полностью запассивированных металлов по достижении потенциала Епо (потенциал питтингообразования) наблюдается местное нарушение пасC
77
сивности – питтинг (реакции (6.9) и (6.10). При этом возрастает скорость анодного процесса (кривая NO).
Если металл склонен к перепассивации, то при достаточно электроC положительном Ет ещё до начала выделения кислорода, возможен переC ход металла в транспассивное состояние (отрезок ТQ), а также явление вторичной пассивности (отрезок Q´R) изCза образования новых труднорасC творимых соединений.
При потенциалах положительнее точки R на вторично пассивном меC талле выделяется кислород (отрезок RG C реакции (6.12) и (6.13)).
Важными пассивационными характеристиками являются:
• потенциал начала видимой пассивации (Екр),
• критическая плотность тока iкр,
• потенциал полной пассивации Епп,
• плотность тока полной пассивации iпп,
• область потенциалов ;Епп = ЕппЕт, в которой металл (сплав)
пребывает в пассивном состоянии.
Чем отрицательнее Екр и меньше iкр, тем легче наступает пассивность металла.
Чем больше ;Епп, тем в более широких пределах изменения потенциC ала будет сохраняться пассивное состояние. К резкому уменьшению ;Епп приводит наличие депассиваторов в коррозионной среде. Рост температуC ры, как правило, способствует увеличению iкр, iпп. Величины пассивационC ных характеристик определяются природой металла и среды. Они имеют важное значение при осуществлении анодной защиты металлоконструкC ций. Анодная защита применяется для конструкционных материалов, склонных к пассивации в данной коррозионной среде (растворы: кислот, щелочей, солей).
Суть анодной защиты сводится к переводу металла (сплава) в пассивное состояние (область потенциалов ;Епп) и поддержание пас% сивности с помощью анодной поляризации внешним током.
Принципиальная схема анодной защиты представлена на рис. 6.3. Она состоит из двух цепей:
C силовой цепи, в которой выходные клеммы источника питания 5 соC единены со вспомогательным электродом (катодом) 2;
78
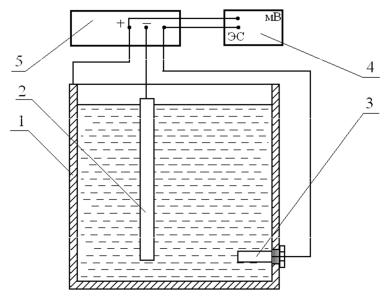
C измерительной (потенциальной) цепи, состоящей из защищаемой конструкции 1, милливольтметра 4 и электрода сравнения 3, соединённых с клеммами источника питания.
Рис.6.3. Схема анодной защиты: 1 – защищаемая конструкция; 2 – катод; 3 – элекC трод сравнения; 4 – прибор для измерения потенциала; 5 – источник питания (потенC
циостат).
Очень часто в качестве источника питания в установках анодной защиты используют потенциостаты C приборы, включающие в себя выпрямитель и электронную систему, обеспечивающую автоматическое поддержание определенного значения потенциала защищаемого объекта. Промышленные потенциостаты позволяют поддерживать потенциал объC екта с точностью ±10мВ и отличаются от лабораторных потенциостатов своей мощностью.
В некоторых случаях (широкая область ;Епп) вместо дорогостоящих потенциостатов применяют стабилизированные источники тока с ручным управлением.
Необходимо отметить, что режим формирования пассивирующего слоя и поддержания металла в пассивном состоянии существенно разлиC чаются.
Для перевода металла в пассивное состояние (пусковой режим) необC ходимо обеспечить анодную плотность тока для поддержания металла в пассивном состоянии iпп. Поэтому пассивация сразу всей поверхности меC талла не осуществима с помощью потенциостата.
Обычно пусковой режим достигается одним из следующих способов:
79
