
- •Глава 1. Характеристика района
- •1.1 Физико-географический очерк
- •1.2. Геологическое строение и гидрогеологические условия
- •1.3. Почвенный покров
- •1.4 Растительный и животный мир
- •1.5 Экологическая ситуация
- •Глава 2. Методики полевых исследований, отбора и обработки проб
- •2.1. Выбор сред опробования и его обоснование
- •2.2 Методика отбора и обработки почв
- •2.3. Опробование вод и донных отложений водоемов
- •Глава 3. Методы лабораторных исследований
- •3.1. Потенциометрия
- •Перманганатный метод
- •3.3 Титриметрическое определение хлора
- •3.4. Определение тяжелых металлов в пробах воды методом ивам
- •3.5 Карбонатная система
- •Расчет концентраций карбонат- и бикарбонат-ионов по измеренным величинам щелочности и рН Определение общей щелочности
- •Расчет концентраций карбонат- и бикарбонат-ионов по измеренным величинам щелочности и рН
- •2. Оценка степени насыщения вод по карбонату кальция
- •Определение концентрации кальция
- •Глава 4. Результаты, их обработка и обсуждение
- •4.1 Состояние почв в зоне влияния мкад
- •4.2 Состояние водных объектов
- •Заключение
- •Список литературы
2. Оценка степени насыщения вод по карбонату кальция
Для оценки степени насыщения вод по карбонату кальция проводилось насыщение раствора, которое создавалось путем добавления навески карбоната кальция в исследуемые пробы профильтрованной воды. Затем производилось встряхивание полученного раствора для растворения навески в течении двух суток.
Ионы образуют труднорастворимое соединение с Ca2+ – карбонат кальция. Активности ионов и Ca2+ связаны между собой термодинамическим произведением растворимости CaCO3:
![]() (20)
(20)
По определению степень насыщения
раствора относительно CaCO3
(![]() )
равна [Хамский, 1979]:
)
равна [Хамский, 1979]:
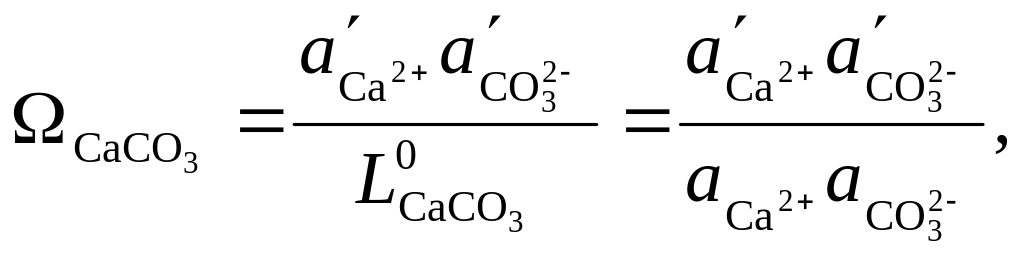 (21)
(21)
где
![]() и a – соответственно
активности ионов в исследуемых растворах
в естественном состоянии и в тех же
растворах после их насыщения по CaCO3,
которое создается путем добавления
навески карбоната кальция.
и a – соответственно
активности ионов в исследуемых растворах
в естественном состоянии и в тех же
растворах после их насыщения по CaCO3,
которое создается путем добавления
навески карбоната кальция.
Поскольку для вод изучаемого района различия общих коэффициентов активности ионов Ca2+ и в естественных условиях и в равновесии с CaCO3 незначительны, это позволяет использовать для определения приближенное уравнение:
![]() (22)
(22)
где в числителе и знаменателе находятся концентрации ионов Ca2+ и в растворах до и после их уравновешивания с CaCO3.
Для проведения расчетов необходимо определить концентрацию ионов Ca2+ и вычислить содержание карбонат-ионов по измеренным величинам щелочности и рН. Результаты расчетов представлены в табл. 3 (см. образец).
Определение концентрации кальция
Принцип метода. Определение концентрации ионов кальция проводится объемным трилонометрическим методом, основанном на применении сильного комплексообразователя трилона Б в присутствии индикатора мурексида.
Мурексид представляет собой однозамещенную
аммониевую соль пурпурной кислоты (![]() ).
Водный раствор мурексида в сильнощелочной
среде (рН > 10) имеет лиловый цвет,
обусловленный окраской анионов пурпурной
кислоты. В присутствии ионов кальция
раствор мурексида окрашивается в красный
цвет за счет образующегося комплекса
пурпурата кальция –
).
Водный раствор мурексида в сильнощелочной
среде (рН > 10) имеет лиловый цвет,
обусловленный окраской анионов пурпурной
кислоты. В присутствии ионов кальция
раствор мурексида окрашивается в красный
цвет за счет образующегося комплекса
пурпурата кальция –
![]() .
При титровании такого раствора трилоном
Б образуется более прочное комплексное
соединение кальция с трилоном, а ионы
пурпурной кислоты освобождаются и
окрашивают раствор в лиловый цвет.
.
При титровании такого раствора трилоном
Б образуется более прочное комплексное
соединение кальция с трилоном, а ионы
пурпурной кислоты освобождаются и
окрашивают раствор в лиловый цвет.
Определение нормальности трилона Б. Пипеткой отмеряют 5 мл 0.1 N раствора MgSO4 и доливают до 50 мл дистиллированной водой. Затем добавляют 2.5 мл аммиачного буфера и 0.2 г индикатора хромогена черного, смешанного с NaCl. Титруют раствором трилона Б до появления голубой окраски от одной прилитой капли. Дальнейшее прибавление трилона не изменяет голубой окраски раствора, поэтому титрование следует проводить аккуратно, наблюдая за постепенным изменением окраски от винно-красной через переходные фиолетовую и грязно-синюю до голубой.
![]() ,
(23)
,
(23)
Определение кальция. К 50 мл исследуемого раствора добавляют 2.5 мл 2 М NaOH и 0.2 г индикатора мурексида, смешанного с NaCl. Титруют 0.05 N раствором трилона Б до появления четко выраженной лиловой окраски, устойчивой в течение 3–5 мин. (оттитрованная проба сохраняет лиловую окраску недолго).
Вычисление результатов анализа:
![]() (24)
(24)
где
![]() – количество трилона Б, израсходованного
на титрование пробы, мл;
– количество трилона Б, израсходованного
на титрование пробы, мл;
![]() – нормальность раствора трилона Б (0.05
N);
– объем пробы, мл;
20.04 – эквивалентный
вес кальция.
– нормальность раствора трилона Б (0.05
N);
– объем пробы, мл;
20.04 – эквивалентный
вес кальция.
Результаты расчетов представлены в таблице 3.5.3
Таблица 3.5.3. Расчет степени насыщения вод у р. Ички по карбонату кальция
№ пробы |
Са, мг/л |
Ca, M |
COз, M |
[Ca]*[COз] |
Степень нас-я |
1 ф |
36,9 |
9,22E-04 |
1,69E-05 |
1,56E-08 |
0,86 |
1ф-нас |
35,0 |
8,73E-04 |
2,07E-05 |
1,81E-08 |
- |
32 ф |
34,0 |
8,49E-04 |
1,41E-05 |
1,19E-08 |
0,71 |
32 ф-нас |
29,2 |
7,28E-04 |
2,30E-05 |
1,67E-08 |
- |
ф – фильтрованная
нас – насыщенная СaCO3
Полученные результаты свидетельствуют о том, что воды в р. Ички не насыщены по карбонату кальция.
