
- •1. Изучаемые объекты и методы определения состояния водоемов
- •1.1. Изучаемые объекты и их физико-географические и гидрологические характеристики
- •1.2. Необходимость комплексных исследований пресноводных водоемов.
- •2. Стандартные способы и приборы для отбора проб воды для определения химических компонентов
- •3. Необходимые вспомогательные показатели и методы их определения.
- •3.1. Температура – фактор, влияющий на процессы в водоеме. Способы измерения температуры.
- •3.2. Термический режим озер и его связь с распределением веществ.
- •3.3. Прозрачность воды и ее значение для протекания биологических процессов
- •4. Методы с использованием гидрохимических анализов.
- •4.1.Растворенный кислород как фактор экологического состояния водоема.
- •4.1.1. Методика определения содержания растворенного кислорода методом титрования (по Винклеру).
- •4.2. Натурные наблюдения за изменением концентрации кислорода в течение дня.
- •4.3 Использование метода Винклера при определении первичной продукции (по Винбергу).
- •4.3.1. Изучение динамики изменения продукции в течение 6-8 часов на оптимальной глубине.
- •4.3.2. Определение суммарного содержания лабильных органических веществ.
- •4.4. Понятие окисляемости. Метод перманганатной окисляемости
- •4.4.1. Перманганатная окисляемость (метод Кубеля)
- •4.4.2.Динамика величины перманганатной окисляемости в течение светового дня.
- •5. Применение инструментальных методов для определения ряда гидрохимических показателей.
- •5.1. Фотоэлектроколориметрические методы.
- •5.1.1. Фосфор – лимитирующий фактор фотосинтетической активности. Фосфорная нагрузка и эвтрофирование.
- •5.1.1.1.Определение фосфатов с молибдатом аммония
- •5.1.2. Кремний
- •5.1.2.1 Определение кремния с молибдатом аммония
- •5.1.3. Нитраты
- •5.1.3.1. Определение нитратов с салицилатом натрия
- •5.1.4. Аммиак и ионы аммония
- •5.1.4.1.Определение с реактивом Несслера
- •5.1.5. Железо
- •5.1.5.1.Определение с роданидом
- •5.2. Ионометрический метод.
- •5.2.1. Водородный показатель( рН)
- •5.2.2. Изучение динамики рН и других параметров в течение дня на озере.
- •5.2.3. Изучение закономерности изменения рН и других параметров от глубины.
- •6. Метод атомно-абсорбционной спектрофотометрии (аас).
- •6.1. Расчет содержания железа в водном гуминовом веществе.
- •7. Хроматографические методы определения органических веществ.
- •7.1. Определение органических веществ в сложных природных смесях.
- •7.2. Изучение динамики изменения содержания низкомолекулярных веществ в течение 8-ми часов.
- •8. Биоиндикация в рамках полевой практики.
- •8.1. Использование индекса Вудивисса для оценки экологического состояния водных объектов
- •8.1.3. Оценка качества воды по индексу Вудивисса (tbi)
- •9. Заключение
- •(По: Save Our Streams. Project Heartbeat. Volunteer Monitoring handbook. 1999; из Скворцов и др., 2001; с изменениями)
- •Методические указания к проведению летней учебной полевой практики по исследованию внутренних водоемов северо-западного региона России.
8.1. Использование индекса Вудивисса для оценки экологического состояния водных объектов
В рамках проводимой практики студенты знакомятся с методом биоиндикации качества воды в водоемах на примере биотического индекса Вудивисса или биотического индекса реки Трент (Trent Biotic Index (TBI)).
Индекс TBI был разработан Франком Вудивиссом в 60-х годах ХХ столетия для индикации воды английской реки Trent и является одним из наиболее распространенных индексов, используемых в странах ЕС, СНГ и в остальном мире.
Индекс основан на двух параметрах бентосного сообщества: общее разнообразие беспозвоночных и наличие в водоеме организмов, принадлежащих к «индикаторным» группам. При повышении степени загрязненности водоема представители этих групп исчезают из сообщества в определенном порядке (табл.6).
В основном индекс используется для определения экологического состояния лотических (текучих) водоемов, но в отдельных случаях возможно его применение и для озерной литорали (например, прибойная каменистая литораль).
8.1.2. Методика отбора и обработки проб бентоса.
Очень важно, чтобы в пробах на каждом из обследованных участков были представлены донные организмы по возможности различных биотопов: илистых, песчаных и каменистых грунтов; скоплений растительности, а также ее остатков; погруженных в воду стволов, веток и иных предметов и т. п. Чем разнообразнее участок по числу местообитаний, тем число проб должно быть больше. Но и на участках с однообразным дном число проб не должно быть менее трех.
Пробы грунта с бентосными организмами для качественного и полуколичественного анализа можно отобрать с помощью специальных приборов: закидной драги (рис. 5) или бентосного скребка (рис. 6). Закидная драга в своей основе состоит из треугольной металлической рамы. Плоские ребра рамы можно заточить, чтобы они лучше выполняли функцию скребка. По одной стороне пластинок делаются отверстия и к ним пришивается мешок из мельничного газа с диаметром ячеи 125 – 250 мкм. Если газа нет, то можно использовать плотную мешковину. Задний конец мешка лучше сделать открытым и завязывать его, чтобы можно было вынимать содержимое драги, не выворачивая ее. К углам металлической рамы крепятся приводящие тросики, а к ним основная веревка. На этой веревке драга может быть закинута для взятия пробы с лодки или с берега (в том числе в труднодоступные места). Проводку драги следует осуществлять равномерно и не быстро. Пройденное расстояние замеряется по длине выбранной веревки.
Скребок представляет собой сачок, у которого внешняя сторона дугообразного обода изготавливается из заточенной металлической пластины длиной 20-25 см. Мешок скребка, как и драги, делается из мельничного газа или плотной мешковины. Скребком удобно брать пробы как со дна в литорали водоема, так и соскабливать обрастания с крупных камней, затопленных деревьев, растений и других предметов.
Во время отбора проб движение скребка и драги по возможности следует направлять против течения, чтобы отловленные организмы не вымывались из них водой.
Отобранные драгой или сачком пробы в них же и промывают, чтобы избавиться от лишнего тонкодисперсного материала, который будет затруднять разборку. Проба считается промытой, когда она уже не замутняет воду. Промытые пробы помещают в емкости с крышками или защелкивающиеся полиэтиленовые пакеты и доставляются в лабораторию для обработки. Каждая проба снабжается подробной этикеткой.
В тех же местах, где отбираются пробы бентоса, следует отобрать пробы на химический анализ, в том числе на содержание кислорода. Фиксация последнего должна производится сразу после отбора пробы.
Отбор организмов из промытого грунта можно выполнить в лаборатории, непосредственно во время определения качества воды по индексу Вудивисса. При этом небольшую порцию грунта переносят в кювету с водой и с помощью пинцета перекладывают животных в баночки (чашки Петри). При необходимости отобранные животные могут быть зафиксированы при помощи 4%-ного раствора формалина или 70о этилового спирта и помещены в пластиковые или стеклянные контейнеры (баночки) для хранения. На баночки наклеиваются этикетки, на которых указываются название водоема, дата, место и глубина отбора пробы. Промытые пробы в живом состоянии могут храниться в холодильнике в течение 1 — 2 суток.
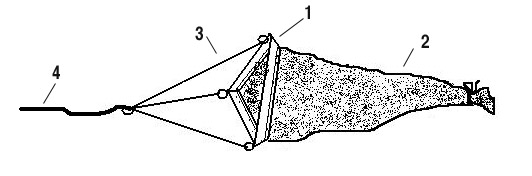
Рис. 5. Бентосная драга: 1 – металлическая рама, 2 – мешок из мельничного газа, 3 – приводящие тросики, 4 – основная веревка
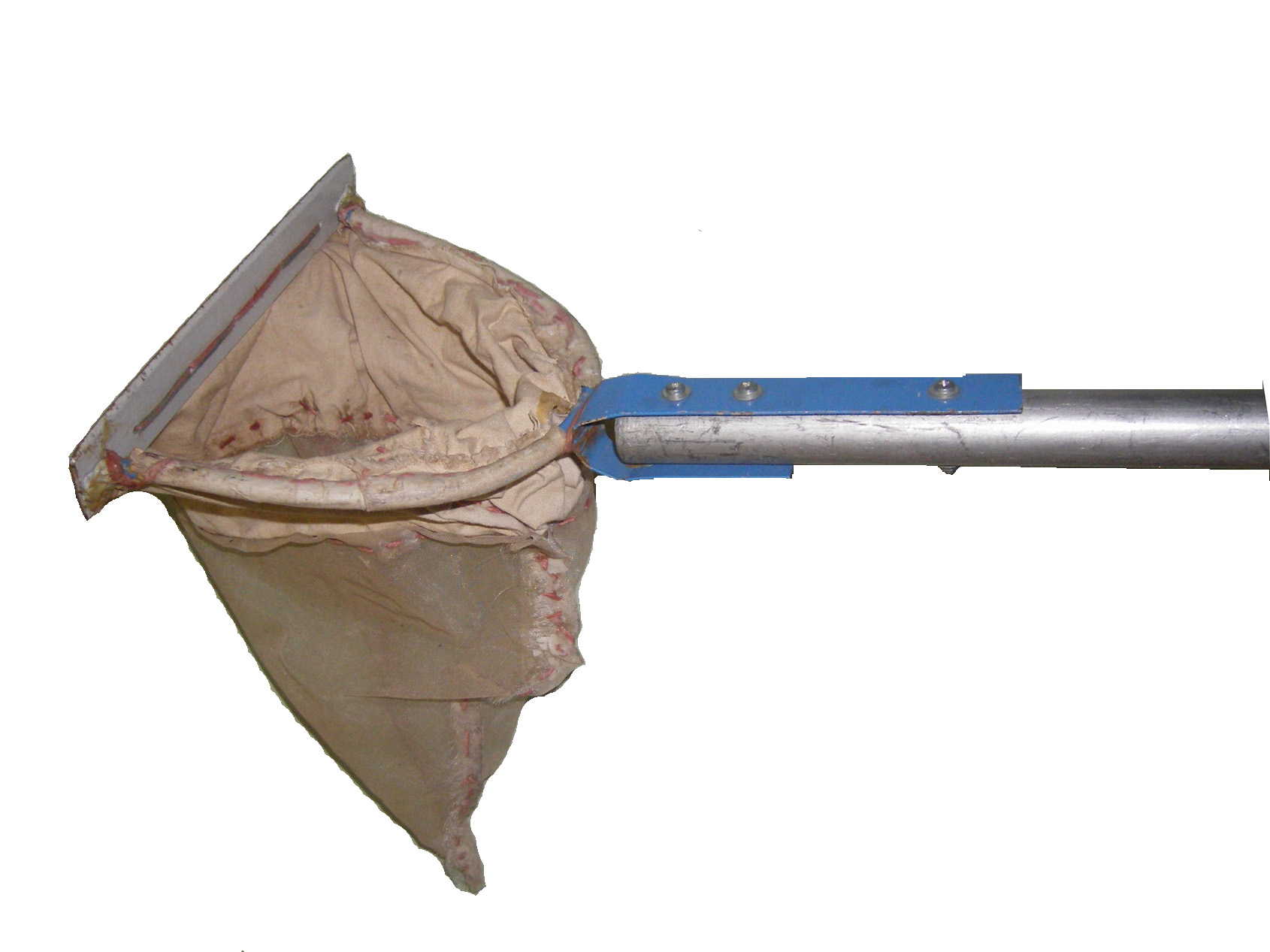
Рис. 6. Бентосный скребок-сачок.
