- •1. Происхождение Вселенной. Экспериментальные основания теории горячей Вселенной, или Большого Взрыва. Эволюция Вселенной.
- •2. Строение и происхождение Солнечной системы, основные гипотезы.
- •3. Образование и внутреннее строение Земли. Сейсмологический метод и его роль в изучении Земли.
- •4. Строение земной коры и верхней мантии. Методы изучения.
- •5. Магнитное поле Земли, его параметры и возможное образование. Палеомагнитный метод.
- •6. Тепловое поле Земли.
- •7. Литосфера, астеносфера. Особенности, выделение, роль в геологии.
- •8. Магматические горные породы и их классификация.
- •9. Особенности строения метаморфических горных пород. Стадии регионального метаморфизма.
- •10. Осадочные горные породы и их классификация.
- •11. Процессы выветривания, основные формы и факторы выветривания.
- •12. Взаимосвязь различных видов эоловых процессов.
- •13. Пустыни как области максимального развития эолового процесса. Типы пустынь. Формирование эолового рельефа и движение песков.
- •14. Геологическая деятельность поверхностных текучих вод. Образование делювия и пролювия.
- •16. Виды эрозии в речных потоках, профиль равновесия реки и факторы его определяющие.
- •17. Образование, типы, режим и рельефообразующая деятельность ледников.
- •18. Водно-ледниковые отложения, особенности строения и рельефа перигляциальных областей.
- •19. Происхождение, типы и геологическая деятельность подземных вод.
- •20. Карстовые процессы, распространение, типы карста и его поверхностные формы
- •21. Мерзлотно-геологические процессы в криолитозоне.
- •22. Основные понятия о многолетнемерзлых породах, распространение, мощность, типы подземных льдов, возникновение криолитозоны.
- •23. Типы гравитационных геологических процессов на склонах.
- •24. Оползни, факторы их возникновения, морфология оползневых тел, меры борьбы с ними.
- •25. Дифференциация магмы и превращение ее в горную породу.
- •26. Продукты извержения вулканов и строение лавовых потоков.
- •27. Трещинный и ареальный типы вулканизма. Типы вулканических аппаратов и их строение.
- •28. Связь вулканизма с интрузивным магматизмом, понятие о магматическом очаге и дифференциации магмы.
- •29. Интрузивный магматизм и типы интрузивных тел.
- •30. Географическое распространение и геологическая позиция современного вулканизма
- •31. Понятие о метаморфизме и его факторах, типы метаморфизма.
- •32. Основные черты рельефа океанского дна
- •33. Строение пассивной континентальной окраины, ее происхождение
- •34. Строение активных континентальных окраин, их происхождение
- •35. Строение и рельеф срединно-океанских хребтов. Их происхождение.
- •36. Абиссальные равнины и их типы, распространение, гайоты.
- •37. Характеристика основных типов морского осадконакопления.
- •38. Движение морской воды, его причины, основные течения.
- •39. Приливы и отливы, причины возникновения, геологическая роль.
- •41. Геологическая роль организмов в процессах, протекающих в Мировом океане
- •42. Биогенное осадконакопление.
- •43. Понятие о лизоклине, критической глубине карбонатонакопления и глубине карбонатной компенсации.
- •44. Глубоководное осадконакопление и его особенности.
- •45. Турбидные потоки, их происхождение и формирование флиша.
- •46. Разрушительная работа моря. Общая характеристика.
- •47. Формирование пляжей, прибрежные морские аккумулятивные формы рельефа.
- •48. Понятие об осадочных фациях.
- •49. Слой и слоистость. Взаимоотношение слоистых толщ. Трансгрессивное и регрессивное залегание отложений, их образование и выражение в геологическом разрезе.
- •50. Типы несогласий, их происхождение и выражение в разрезе и на геологической карте.
- •51. Складчатые деформации. Элементы складки, типы и формы складок, их образование
- •52. Разрывные деформации. Типы разрывных нарушений. Элементы разрыва, условия образования.
- •53. Понятие о землетрясениях, их параметры.
- •54. Географическое распространение и геологические обстановки возникновения землетрясений, сейсмофокальные зоны Беньоффа.
- •55. Характеристика континентов и океанов как важнейших структур земной коры
- •56. Линейные вулканические архипелаги, их происхождение и строение, понятие о «горячих точках» и их значение для тектоники литосферных плит.
- •57. Тектоника литосферных плит, истоки, развитие и содержание
- •58. Современные движения земной коры. Методы и результаты их изучения.
- •59. Тектонические процессы на дивергентных границах литосферных плит.
- •60. Тектонические процессы на конвергентных границах литосферных плит.
- •1.Электронная структура и размеры атомов в кристаллах: ионные, атомные и ковалентные радиусы. Типы химической связи и координация атомов.
- •2. Принципы теории плотнейших упаковок и полиэдрическое описание кристаллических структур минералов.
- •3. Гомо- и гетеродесмические структуры кристаллов. Структурные типы минералов.
- •4. Полиморфизм и политипия.
- •5. Морфология и внутреннее строение кристаллов и их зависимость от условий роста.
- •6. Искаженные формы кристаллов. Закономерные сростки кристаллов: двойники, топо-, син- и эпитаксические сростки.
- •7. Морфология кристаллических агрегатов минералов. Сферолиты.
- •8. Химический состав минералов. Изоморфизм, твердые растворы, явление упорядочения и распад твердых растворов.
- •9. Физические свойства минералов, их природа и зависимость от химического состава и структуры.
- •10. Инструментальные методы исследования минералов, руд и горных пород.
1.Электронная структура и размеры атомов в кристаллах: ионные, атомные и ковалентные радиусы. Типы химической связи и координация атомов.
Электронная конфигурация — формула расположенияэлектронов по различным электронным оболочкам атомахимического элемента или молекулы.
С точки зрения квантовой механики электронная конфигурация — это полный перечень одноэлектронных волновых функций, из которых с достаточной степенью точности можно составить полную волновую функцию атома (в приближении самосогласованного поля).
Вообще говоря, атом, как составную систему, можно полностью описать только полной волновой функцией. Однако такое описание практически невозможно для атомов сложнее атома водорода — самого простого из всех атомов химических элементов. Удобное приближённое описание — метод самосогласованного поля. В этом методе вводится понятие о волновой функции каждого электрона. Волновая функция всей системы записывается как надлежащим образом симметризованое произведениеодноэлектронных волновых функций. При вычислении волновой функции каждого электрона поле всех остальных электронов учитывается как внешний потенциал, зависящий в свою очередь от волновых функций этих остальных электронов.
В результате применения метода самосогласованного поля получается сложная система нелинейныхинтегродифференциальных уравнений, которая всё ещё сложна для решения. Однако уравнения самосогласованного поля имеют вращательную симметрию исходной задачи (то есть они сферически симметричны). Это позволяет полностью классифицировать одноэлектронные волновые функции, из которых составляется полная волновая функция атома.
Для
начала, как в любом центрально симметричном
потенциале, волновую функцию в
самосогласованном поле можно
охарактеризовать квантовым
числом полного углового
момента ![]() и
квантовым числом проекции углового
момента на какую-нибудь ось
и
квантовым числом проекции углового
момента на какую-нибудь ось ![]() .
Волновые функции с разными
значениями
соответствуют
одному и тому же уровню энергии, т. е.
вырождены. Также одному уровню энергии
соответствуют состояния с разной
проекцией спина электрона
на какую-либо ось. Всего для данного
уровня энергии
.
Волновые функции с разными
значениями
соответствуют
одному и тому же уровню энергии, т. е.
вырождены. Также одному уровню энергии
соответствуют состояния с разной
проекцией спина электрона
на какую-либо ось. Всего для данного
уровня энергии ![]() волновых
функций. Далее, при данном значении
углового момента можно перенумеровать
уровни энергии. По аналогии с атомом
водорода принято нумеровать уровни
энергии для данного
начиная
с
волновых
функций. Далее, при данном значении
углового момента можно перенумеровать
уровни энергии. По аналогии с атомом
водорода принято нумеровать уровни
энергии для данного
начиная
с ![]() .
Полный перечень квантовых чисел
одноэлектронных волновых функций из
которых можно составить волновую функцию
атома и называется электронной
конфигурацией. Поскольку всё вырожденно
по квантовому числу
и
по спину, достаточно только указывать
полное количество электронов, находящихся
в состоянии с данными
.
Полный перечень квантовых чисел
одноэлектронных волновых функций из
которых можно составить волновую функцию
атома и называется электронной
конфигурацией. Поскольку всё вырожденно
по квантовому числу
и
по спину, достаточно только указывать
полное количество электронов, находящихся
в состоянии с данными ![]() ,
.
,
.
Ио́нный ра́диус — характерный размер шарообразных ионов, применяемый для вычисления межатомных расстояний в ионных соединениях. Понятие ионный радиус основано на предположении, что размеры ионов не зависят от состава молекул, в которые они входят. На него влияет количество электронных оболочек и плотность упаковки атомов и ионов в кристаллической решётке.
Атомный радиус — радиус, характеризующий приблизительный размер атома. С увеличением атомного номера элемента Атомный радиус уменьшается, поскольку возрастает заряд ядра.
Ковалентный радиус в химии — это половина расстояния между ядрами атомов данного элемента, образующими ковалентную связь. За величину ковалентного радиуса принимается половина кратчайшего межатомного расстояния в кристалле простого вещества. Другими словами, если обозначить через X атомы элемента, образующего кристалл с ковалентной связью, то для галогенов ковалентный радиус равен половине длины связи в молекуле X2, для серы и селена — половине длины связи в молекуле X8, а для углерода и кремния он принимается равным половине кратчайшего межатомного расстояния в кристаллах алмаза и кремния.
Ковалентный радиус характеризует распределение электронной плотности вблизи ядра и близок к другим характеристикам распределения электронной плотности (радиус Ван-дер-Ваальса, Боровский радиус для атома водорода и т. п.)
Cумма ковалентных радиусов должна быть равна длине ковалентной связи между двумя атомами, R (AB) = R (A) + R (B).
Ковалентная связь – наиболее общий вид химической связи, возникающий за счет обобществления электронной пары посредством обменного механизма, когда каждый из взаимодействующих атомов поставляет по одному электрону, или по донорно-акцепторному механизму, если электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору)
Классический пример неполярной ковалентной связи (разность электроотрицательностей равна нулю) наблюдается у гомоядерных молекул: H–H, F–F. Энергия двухэлектронной двухцентровой связи лежит в пределах 200–2000 кДж∙моль–1.
При образовании гетероатомной ковалентной связи электронная пара смещена к более электроотрицательному атому, что делает такую связь полярной. Ионность полярной связи в процентах вычисляется по эмпирическому соотношению 16(χA – χB) + 3,5(χA – χB)2, где χA и χB – электроотрицательности атомов А и В молекулы АВ. Кроме поляризуемости ковалентная связь обладает свойством насыщаемости – способностью атома образовывать столько ковалентных связей, сколько у него имеется энергетически доступных атомных орбиталей. О третьем свойстве ковалентной связи – направленности – речь пойдет ниже (см. метод валентных связей).
Ионная связь – частный случай ковалентной, когда образовавшаяся электронная пара полностью принадлежит более электроотрицательному атому, становящемуся анионом. Основой для выделения этой связи в отдельный тип служит то обстоятельство, что соединения с такой связью можно описывать в электростатическом приближении, считая ионную связь обусловленной притяжением положительных и отрицательных ионов. Взаимодействие ионов противоположного знака не зависит от направления, а кулоновские силы не обладают свойством насыщености. Поэтому каждый ион в ионном соединении притягивает такое число ионов противоположного знака, чтобы образовалась кристаллическая решетка ионного типа. В ионном кристалле нет молекул. Каждый ион окружен определенным числом ионов другого знака (координационное число иона). Ионные пары могут существовать в газообразном состоянии в виде полярных молекул. В газообразном состоянии NaCl имеет дипольный момент ~3∙10–29 Кл∙м, что соответствует смещению 0,8 заряда электрона на длину связи 0,236 нм от Na к Cl, т. е. Na0,8+Cl0,8–.
Металлическая связь возникает в результате частичной делокализации валентных электронов, которые достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с положительно заряженными ионами. Силы связи не локализованы и не направлены, а делокализированные электроны обусловливают высокую тепло- и электропроводность.
Водородная связь. Ее образование обусловленно тем, что в результате сильного смещения электронной пары к электроотрицательному атому атом водорода, обладающий эффективным положительным зарядом, может взаимодействовать с другим электроотрицательным атомом (F, O, N, реже Cl, Br, S). Энергия такого электростатического взаимодействия составляет 20–100 кДж∙моль–1. Водородные связи могут быть внутри- и межмолекулярными. Внутримолекулярная водородная связь образуется, например, в ацетилацетоне и сопровождается замыканием цикла (рис. 3.3).
Исключительно важную роль водородная связь играет в биологических макромолекулах, таких неорганических соединениях как H2O, H2F2, NH3. За счет водородных связей вода характеризуется столь высокими по сравнению с H2Э (Э = S, Se, Te) температурами плавления и кипения. Если бы водородные связи отсутствовали, то вода плавилась бы при –100 °С, а кипела при –80 °С.
Ван-дер-ваальсова (межмолекулярная) связь – наиболее универсальный вид межмолекулярной связи, обусловлен дисперсионными силами (индуцированный диполь – индуцированный диполь), индукционным взаимодействием (постоянный диполь – индуцированный диполь) и ориентационным взаимодействием (постоянный диполь – постоянный диполь). Энергия ван-дер-ваальсовой связи меньше водородной и составляет 2–20 кДж∙моль–1.
Химическая связь в твердых телах. Свойства твердых веществ определяются природой частиц, занимающих узлы кристаллической решетки и типом взаимодействия между ними.
Твердые аргон и метан образуют атомные и молекулярные кристаллы соответственно. Поскольку силы между атомами и молекулами в этих решетках относятся к типу слабых ван-дер-ваальсовых, такие вещества плавятся при довольно низких температурах. Большая часть веществ, которые при комнатной температуре находятся в жидком и газообразном состоянии, при низких температурах образуют молекулярные кристаллы.
Температуры плавления ионных кристаллов выше, чем атомных и молекулярных, поскольку электростатические силы, действующие между ионами, намного превышают слабые ван-дер-ваальсовы силы. Ионные соединения более твердые и хрупкие. Такие кристаллы образуются элементами с сильно различающимися электроотрицательностями (например, галогениды щелочных металлов). Ионные кристаллы, содержащие многоатомные ионы, имеют более низкие температуры плавления; так для NaCl tпл. = 801 °C, а для NaNO3 tпл = 306,5 °C.
В ковалентных кристаллах решетка построена из атомов, соединенных ковалентной связью, поэтому эти кристаллы обладают высокими твердостью, температурой плавления и низкими тепло- и электропроводностью.
Кристаллические решетки, образуемые металлами, называются металлическими. В узлах таких решеток находятся положительные ионы металлов, в межузлиях – валентные электроны (электронный газ).
Наибольшую температуру плавления из металлов имеют d-элементы, что объясняется наличием в кристаллах этих элементов ковалентной связи, образованной неспаренными d-электронами, помимо металлической, образованнной s-электронами.
Координационная геометрия атома в геометрическом соединении, образованном атомами вокруг центрального атома.
Координационные комплексы неорганических соединений
В области неорганических геометрических комплексов координации эти соединения являются геометрическими моделями, образованными атомами лигандов, которые связаны с центральным атомом в молекуле и комплексным соединением. Геометрическое расположение варьируется в зависимости от количества и типа лигандов, связанных с центром, состоящим из металла, а также координационного преимущества (англ. the coordination preference) центрального атома, как правило, металла в координационном комплексе. Число соединений (то есть число σ-связей между центральным атомом и лигандами), называется координационным числом. Геометрическая модель может быть описана как многогранник, где вершины многогранника являются центрами координации атомов лигандов.
Координационное преимущество металла часто варьируется в зависимости от его степени окисления. Число координационных связей (координационное число) может варьироваться от двух до 20.
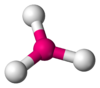
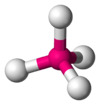
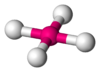
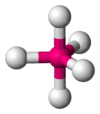
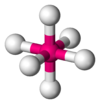
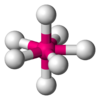
Одна из самых распространенных геометрических координаций — октаэдрическая, где шесть лигандов координируются к металлу симметричным распределением, что ведет к образованию октаэдра, если линии нарисованы между лигандами. Менее встречающиеся в общей геометрии координации являются формы тетраэдра и «плоского квадрата» (2D квадрат).
Теория кристаллического поля может быть использована для объяснения относительной устойчивости соединений переходных металлов различной геометрической координации, а также наличия или отсутствия парамагнетизма.
ТОЭП может быть использована для предсказания геометрии комплексов основных элементов группы (исключение составляют актиноиды и лантаноиды).
Кристаллографическое использование
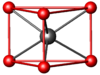
В кристаллической структуре геометрическая модель атома является геометрической структурой координации атомов, где определение координации атомов зависит от связей в модели. Например, в каменной соли, ионный состав каждого атома натрия содержит шесть ближайших соседних хлорид-ионов в октаэдрической геометрии и каждый хлорид аналогично — шесть соседних ионов натрия в октаэдрической геометрии. В металлах с объемноцентрированной структурой каждый атом имеет связь с восмью ближайшими другими атомами с кубической геометрией. В металлах с гранецентрированной кубической структурой каждый атом имеет двенадцать связей с соседними атомами с кубооктаэдрической геометрией.
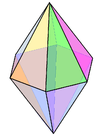
2 |
линейная |
|
Ag(CN)2− в KAg(CN)2 |
Ag в цианиде серебра, Au в AuI |
3 |
плоский треугольник |
|
Cu(CN)32− в Na2Cu(CN)3·3H2O |
O в TiO2(структура рутила) |
4 |
тетраэдр |
|
CoCl42− |
Zn и S в сульфиде цинка, Si вдиоксиде кремния |
4 |
квадрат |
|
AgF4− |
CuO |
5 |
тригональная бипирамидальная |
|
SnCl5− |
|
5 |
квадратная пирамидальная |
|
InCl52− в (NEt4)2InCl5 |
|
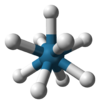
6 |
октаэдр |
|
Fe(H2O)62+ |
Na и Cl в хлориде натрия |
6 |
тригональная призматическая |
|
Mo(SCHCHS)3 |
As в NiAs, Mo вMoS2 |
7 |
пентагональная бипирамидальная |
|
ZrF73− в (NH4)3ZrF7 |
Pa в PaCl5 |
7 |
гранецентрированная октаэдрическая |
|
[HoIII(PhCOCHCOPh)3(H2O)] |
La в La2O3 |
7 |
тригональная призматическая, квадратическая моногранецентрированная |
|
TaF72− в K2TaF7 |
|
8 |
куб |
|
|
Хлорид цезия,фторид кальция |
8 |
квадратная антипризматическая |
|
TaF83− в Na3TaF8 |
Хлорид тория(IV) |
8 |
додекаэдр |
|
Mo(CN)84− в K4[Mo(CN)8].2H2O |
Zr в K2ZrF6 |
8 |
гексагональная бипирамидальная |
|
|
N в Li3N |
8 |
октаэдр |
|
|
Ni в арсениде никеля |
8 |
тригональная призматическая |
|
|
Ca в CaFe2O4 |
8 |
тригональная призматическая, квадратная лицевая двуребристая |
|
|
PuBr3 |
9 |
тригональная призматическая, квадратная лицевая триребристая |
|
[ReH9]2− внонагидроренате калия |
SrCl2·6H2O , Th в RbTh3F13 |
9 |
англ. monocapped square antiprismatic |
|
[Th(торополонат)4(H2O)] |
La в LaTe2 |
10 |
англ. bicapped square antiprismatic |
|
Th(C2O4)42− |
|
11 |
|
|
Th в [ThIV(NO3)4(H2O)3] (NO3−) |
|
12 |
иксоаэдр |
|
Th в Th(NO3)62−-ион в Mg[Th(NO3)6]·8H2O |
|
12 |
кубооктаэдрон |
|
ZrIV(η³−(BH4)4) |
|
12 |
антикубооктаэдон |
|
|
|
14 |
двуребристая антипризматичная гексагональная |
|
|
|