
- •1.Статистический и термодинамический методы
- •2.Молекулярно-кинетическая теория идеальных газов
- •2.1.Основные определения
- •2.2.Опытные законы идеального газа
- •2.3.Уравнение состояния идеального газа (уравнение Клапейрона-Менделеева)
- •2.5.Распределение Максвелла
- •2.6.Распределение Больцмана
- •3.Термодинамика
- •3.1.Внутренняя энергия. Закон равномерного распределения энергии по степеням свободы
- •3.2.Первое начало термодинамики:
- •3.3.Работа газа при изменении его объема
- •3.4.Теплоемкость
- •3.5.Первое начало термодинамики и изопроцессы
- •3.6.Круговой процесс (цикл). Обратимые и необратимые процессы. Цикл Карно.
- •3.7.Второе начало термодинамики
- •3.8.Реальные газы
- •3.8.1.Силы межмолекулярного взаимодействия
- •3.8.2.Уравнение Ван-дер-Ваальса
- •3.8.3.Внутренняя энергия реального газа.
- •3.8.4. Эффект Джоуля-Томсона. Сжижение газов.
2.5.Распределение Максвелла
В газе, находящемся в состоянии равновесия, устанавливается стационарное, не меняющееся со временем распределение молекул по скоростям. Пусть имеетcя N молекул, причем dN(v) - число молекул, имеющих скорость в интервале от v до dv. Как показал Максвелл, для идеального газа справедлив закон распределения молекул идеального газа по скоростям (распределение Максвелла)
dN(v)= N4[m/2kT]3/2v2exp[-mv2/2kT]dv = Nf(v),
(5)
где
f(v) = 4[m/2kT]3/2v2exp[-mv2/2kT]
называется функцией
распределения молекул по скоростям
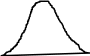
и она показана на рис.3. Относительное
число молекул, скорости которых лежат
в интервале от v до v+dv, равна площади dS
= N(v)/N, заштрихованной на рис.3. Площадь
под кривой f(v) равна единице, т.е. функция
f(v) нормирована на единицу
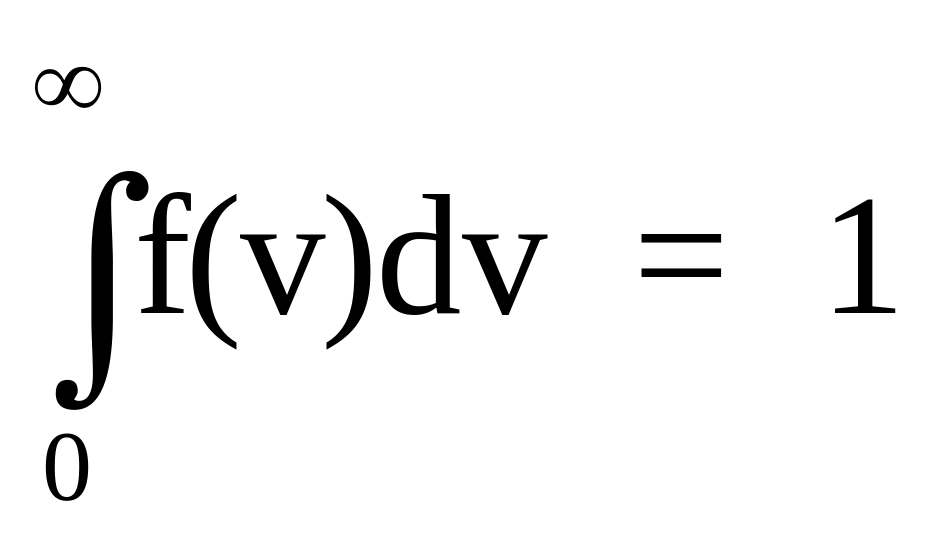
Скорость,
при которой функция распределения f(v)
максимальна, называется
наиболее
вероятной скоростью
vв=![]() (эта скорость находится путем
дифференцирования функции f(v) по аргументу
v и приравнивания результата нулю).
Видно, что повышение температуры смещает
распределение молекул по скоростям
вправо, увеличивая vв,
однако площадь под кривой f(v) остается
неизменной. Иными словами, при
повышении температуры кривая f(v)
растягивается, понижается и смещается
в область больших v
(рис.4).
(эта скорость находится путем
дифференцирования функции f(v) по аргументу
v и приравнивания результата нулю).
Видно, что повышение температуры смещает
распределение молекул по скоростям
вправо, увеличивая vв,
однако площадь под кривой f(v) остается
неизменной. Иными словами, при
повышении температуры кривая f(v)
растягивается, понижается и смещается
в область больших v
(рис.4).
 f(v)
f(v)
f(v)
f(v)
 dS=dN(v)/N
T1
dS=dN(v)/N
T1

 T2
T2


 Рис.3
T2>T1
Рис.4
Рис.3
T2>T1
Рис.4



 vв
<vкв>
v
v
vв
<vкв>
v
v

 dv <v>
dv <v>
Функция
f(v) позволяет найти среднюю
(арифметическую) скорость
молекул
<v> =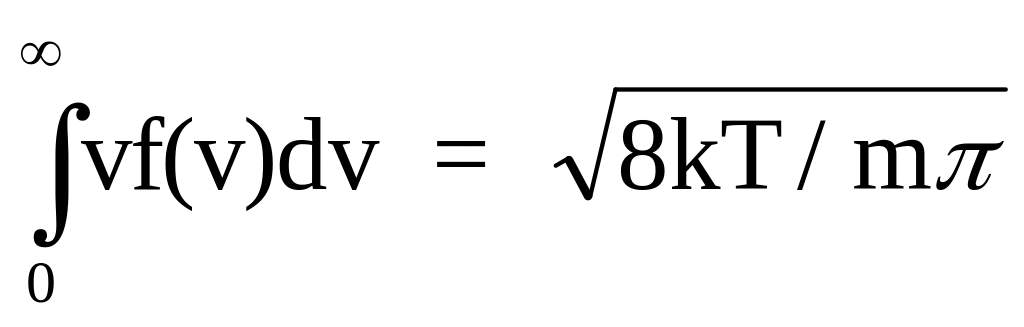 .
.
Таким
образом, скорости, характеризующие
состояние газа: наиболее вероятная vв
=
![]() ,
средняя <v>
=
,
средняя <v>
=
![]() = 1.13vв
и средняя квадратичная <vкв>
=
= 1.13vв
и средняя квадратичная <vкв>
=
![]() =
1.22vв.
=
1.22vв.
Из
распределения молекул по скоростям (5)
можно найти распределение
молекул по кинетическим энергиям (по
энергиям теплового движения)
(распределение
Максвелла-Больцмана)
(для этого следует перейти от переменной
v к переменной E=mv2/2):
число молекул, имеющих кинетическую
энергию, заключенную в интервале энергий
от E до E+dE, равно dN(E) = (2N/![]() )(kT)-3/2E1/2exp(-E/kT)dE
= Nf(E), где f(E) = (2/
)(kT)-3/2E1/2exp(-E/kT)
называется функцией
распределения молекул по кинетическим
энергиям (по энергиям теплового движения),
а
средняя
кинетическая энергия
<E>
молекулы
идеального газа
<Ek>
=
)(kT)-3/2E1/2exp(-E/kT)dE
= Nf(E), где f(E) = (2/
)(kT)-3/2E1/2exp(-E/kT)
называется функцией
распределения молекул по кинетическим
энергиям (по энергиям теплового движения),
а
средняя
кинетическая энергия
<E>
молекулы
идеального газа
<Ek>
=
![]() Ef(E)dE
= 3kT/2, т.е. получили результат, совпадающий
с (4). Функция f(E) приведена на рис.3а и 4а
- она схожа с функцией f(v), но несколько
растянута в области высоких энергий.
Ef(E)dE
= 3kT/2, т.е. получили результат, совпадающий
с (4). Функция f(E) приведена на рис.3а и 4а
- она схожа с функцией f(v), но несколько
растянута в области высоких энергий.
