
Патологические антикоагулянты
При определенных видах патологии в плазме могут накапливаться очень мощные иммунные ингибиторы свертывания крови, являющиеся специфическими антителами против того или иного фактора. Такие антитела могут вырабатываться против любых факторов свертывания крови, но чаще всего в клинике встречаются ингибиторы факторов VIII и IX.
Кроме того, при ряде аутоиммунных процессов и парапротеинемиях в крови могут накапливаться патологические белки, обладающие либо антитромбиновым действием, либо ингибирующим влиянием на факторы Xа, II или V.
ИНГИБИТОРЫ ФИБРИНОЛИЗА.
Они присутствуют в плазме и сыворотке крови. Их можно разделить на антиплазмины и ингибиторы активаторов плазминогена (действующие против стрептокиназы, урокиназы и тканевого активатора плазминогена).
1. Антиплазмины
Из ингибиторов фибринолиза лучше всего изучены антиплазмины. Так, показано, что большинство протеолитических ингибиторов способны нейтрализовать активность плазмина. Антиплазминовое действие оказывают по крайней мере 6 веществ: альфа1-антитрипсин (медленно действующий антиплазмин), альфа2-макроглобулин (быстро действующий антиплазмин), антитромбин III, C1-инактиватор, интер-альфа-ингибитор трипсина и альфа2-антиплазмин. Большинство ингибиторов плазмина находится в избытке и способно образовывать комплексы с плазмином (главным образом обратимые).
альфа 2-антиплазмин представляет собой серпин и является основным ингибитором плазмина в крови. Ему присущи 3 основных свойства: быстро ингибировать плазмин; затруднять присоединение плазминогена к фибрину; образовывать перекрестные связи с альфа-цепями фибрина во время фибринообразования. альфа 2-антиплазмин продуцируется печенью. При избыточном образовании плазмина в крови его нейтрализация происходит в следующей последовательности: альфа 2-антиплазмином, альфа 2-макроглобулином, альфа 1-антитрипсином, антитромбином III и C1-инактиватором. Несмотря на наличие различных ингибиторов, участвующих в инактивации плазмина in vivo, наследственный дефицит альфа 2-антиплазмина проявляется сильным кровотечением – очевидное свидетельство недостаточности контроля активности плазмина другими ингибиторами.
альфа2-макроглобулин (см выше).
2. Ингибиторы активаторов плазминогена:
Синтезируются в основном эндотелиальными клетками, являются белками. К ним относятся: ингибитор активатора плазминогена 1 и 2 (ИАП-1 и 2), С1-ингибитор, гликопротеин, богатый гистидином, фибронектин, фактор Виллебранда (см выше), тромбоспондин.
Фибронектин - гликопротеид, состоящий из двух цепей, соединенных дисульфидными связями. Вырабатывается он всеми клетками сосудистой стенки, тромбоцитами. Фибронектин является рецептором для фибринстабилизирующего фактора. Способствует адгезии тромбоцитов, участвуя в образовании белого тромба; связывает гепарин. Присоединяясь к фибрину, фибронектин уплотняет тромб. Под действием фибронектина клетки гладких мышц, эпителиоцитов, фибробластов повышают свою чувствительность к факторам роста, что может вызвать утолщение мышечной стенки сосудов (сужение диаметра).
Тромбоспондин - гликопротеид, который вырабатывается эндотелием сосудов, но находится и в тромбоцитах. Образует комплексы с коллагеном, гепарином, является сильным агрегирующим фактором, опосредуя адгезию тромбоцитов к субэндотелию.
ЛАБОРАТОРНЫЕ МЕТОДЫ ОЦЕНКИ ПОКАЗАТЕЛЕЙ
СИСТЕМЫ ГЕМОСТАЗА
измерение числа и функции тромбоцитов (адгезия, агрегация) путем микроскопии или с использованием гематологических анализаторов (при скрининговых исследованиях) и агрегометров;
функциональные коагуляционные, или так называемые клоттинговые (по оценке времени свертывания мануально или с использованием коагулометров разных конструкций);
определение параметров фибринолиза;
амидолитические (тесты с использованием хромогенных субстратов к тромбину, плазмину, фактору Xа, XIIIа и др., и фотометров с фиксированной длиной волны измерений);
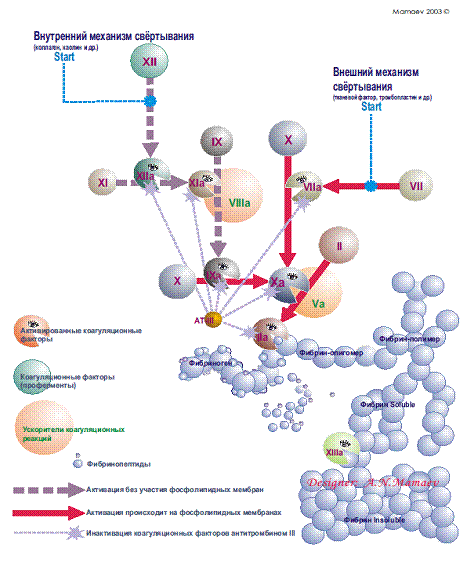
Рис.4. Схема свертывания крови [А.Н. Мамаев 2003]
иммунологические методы, позволяющие выявить уровень искомого антигена или антител при АФС и др.
выявление генетических аномалий методом ПЦР (мутации Лейден-резистентности фактора Vа к активированному протеину С, гена протромбина G 20210, гена метилентетрагидрофолатредуктазы и др.).
НАРУШЕНИЯ СИСТЕМЫ ГЕМОСТАЗА.
Наследственные и приобретённые нарушения гемостаза могут привести как к геморрагическим заболеваниям, характеризующимся кровоточивостью, так и к тромботической болезни. Однако следует отметить, что повышенная склонность к тромбообразованию и внутрисосудистому свёртыванию (тромбофилии) встречается гораздо чаще, чем гемофилии.
Снижение свёртываемости крови. При снижении свёртываемости крови наблюдают заболевания, сопровождающиеся повторяющимися кровотечениями. Гемофилии - наследственные болезни, характеризующиеся повышенной кровоточивостью. Причиной этих кровотечений (спонтанных или вызванных травмой) является наследственная недостаточность белков свёртывающей системы крови.
Гемофилия А (классическая гемофилия) обусловлена мутацией гена фактора VIII, локализованного в X хромосоме. Классическая гемофилия составляет 80% всех случаев заболевания гемофилией. Гемофилия В встречается реже и обусловлена генетическим дефектом фактора IX.
Дефект гена фактора VIII проявляется как рецессивный признак, поэтому этой формой гемофилии болеют только мужчины. Это заболевание сопровождается подкожными, внутримышечными и внутрисуставными кровоизлияниями, иногда опасными для жизни. Дефект фактора VIII встречается примерно у одного из 10 000 новорождённых. Больных лечат препаратами, содержащими фактор VIII, получаемыми из донорской крови или методами генной инженерии.
Снижение фибринолитической активности крови сопровождается тромбозами. Нарушение разрушения фибринового сгустка может быть вызвано наследственным дефицитом плазмино-гена или генетическим дефектом его структуры, снижением поступления в кровь активаторов плазминогена, повышением содержания в крови ингибиторов фибринолиза (и-ТАП-1, и-ТАП-2, α2-антиплазмина).
ДВС-синдром (диссеминированное внутрисосудистое свёртывание, коагулопатия потребления, тромбогеморрагический синдром) — нарушенная свёртываемость крови по причине массивного освобождения из тканей тромбопластических веществ.
Может протекать бессимптомно, или в виде остро развившейся коагулопатии. Часто встречается при различной акушерской патологии, различных видах шока, тяжёлых травмах, бактериальном сепсисе.
Фазы ДВС-синдрома: I фаза — гиперкоагуляция. Потеря факторов свертывающей системы в процессе обильного кровотечения приводит к удлинению времени образования сгустка и его ретракции, удлинению времени капиллярного кровотечения. Лабораторные показатели: уменьшение времени свертывания крови, тромбинового времени, положительный этаноловый тест.
II фаза — гипокоагуляция. При геморрагическом шоке в фазе спазма венул и артериол (клинические проявления: дегидратация, бледные и холодные кожные покровы, признаки острой почечной недостаточности) в капиллярах развивается расслоение плазмы и форменных элементов — “сладж”-феномен. Агрегация форменных элементов, обволакивание их фибрином сопровождаются потреблением факторов свертывания крови и активацией фибринолиза. Лабораторные показатели: умеренная тромбоцитопения (до 120 × 109/л), тромбиновое время 60 с и больше, резко положительный этаноловый тест.
III фаза — потребления с активацией местного фибринолиза. Афибриногенемия в сочетании с выраженной активацией фибринолиза. При этой фазе рыхлые сгустки крови в месте кровотечения быстро (в течение 15-20 мин) лизируются на 50 %. Лабораторные показатели: увеличение времени свертывания крови, тромбинового времени, уменьшение тромбоцитов до 100 × 109/л, быстрый лизис сгустка.
IV фаза — генерализованный фибринолиз. Капиллярная кровь не свертывается, отмечаются паренхиматозное кровотечение, петехиальные высыпания на коже и внутренних органах, гематурия, выпот в синовиальные полости и терминальные изменения в органах и системах.
ТРОМБОЭМБОЛИЧЕСКИЙ СИНДРОМ
Основное проявление синдрома — развитие тромбов и тромбоэмболии в
артериальной части большого круга кровообращения на фоне повышения свертывании крови.
Гиперкоагуляция как общий фактор, способствующий тромбозу, наблюдается
при многих заболеваниях — генетическом дефиците антитромбина III и
протеина С, нефротическом синдроме (приобретенный дефицит антитромбина
111 и повышение концентрации коагулянтов), при тяжелых травмах, ожогах,
онкологических заболеваниях (гиперкоагуляции, гиперфибриногенсмия), в
поздних стадиях беременности и послеродовом периоде. Во всех
перечисленных ситуациях причины гиперкоагуляции различны. В целом они
затрагивают активацию прокоагулянтов (фибриногена, протромбина, факторов
VIIa, VIIla и Ха или увеличение количества тромбоцитов), или уменьшением
активности противосвертывающей и фибринолитических систем.
