
- •Непредельные (ненасыщенные) углеводороды
- •Гомологические ряды непредельных углеводородов и их особенности:
- •Сферы применения предельных углеводородов:
- •Для реакции присоединения характерны:
- •Общая формула кетонов —
- •Применение:
- •Нитро- и аминосоединения ароматического ряда и их производные
- •Химические свойства:
- •Жиры как питательные вещества.
- •Высокомолекулярные соединения (вмс)
Для реакции присоединения характерны:
1) гидрирование (восстановление) с образованием первичных спиртов RСН2ОН.
2) присоединение спиртов с образованием полуацеталей R-СН (ОН) – ОR.
В присутствии катализатора – хлороводорода НСl и при избытке спирта образуются ацетали RСН (ОR)2;
3) присоединение гидросульфита натрия NаНSO3 с образованием гидросульфитных производных альдегидов.
Особенности реакции окисления альдегидов: взаимодействуют с аммиачным раствором оксида серебра (I) и с гидроксидом меди (II) с образованием карбоновых кислот.
Особенности реакции полимеризации альдегидов: 1) характерна линейная полимеризация; 2) характерна циклическая полимеризация (тримеризация, тетрамеризация).
Особенности реакции «серебряного зеркала»: 1) серебро появляется на стенках пробирки в виде блестящего налета; 2) в такой окислительно-восстановительной реакции альдегид превращается в кислоту (при избытке аммиака образуется соль аммония); 3) серебро выделяется в свободном виде; 4) в качестве окислителя альдегидов может быть использован также гироксид меди Сu(ОН)2; 3) если к гидроксиду меди прибавить раствор альдегида и смесь нагреть, наблюдается образование желтого осадка гидроксида меди (I), которая превращается в красный оксид меди; 4) гидроксид меди (II) окисляет альдегид в кислоту, а сам восстанавливается до оксида меди (I).
Реакции с аммиачным раствором оксида серебра (I) и гидроксидом меди (II) могут служить для обнаружения альдегидов.
Карбонильные соединения могут быть восстановлены в спирты. Альдегиды восстанавливаются в первичные спирты, а кетоны – во вторичные. Некоторые методы позволяют восстановить карбонильную группу в метиленовую.
Кетонами называются карбонилсодержащие соединения, в которых углерод карбонильной группы связан с двумя углеродными радикалами.
Общая формула кетонов —
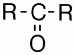
В соответствии с международной номенклатурой названия кетонов строятся из названия соответствующего углеводорода с добавлением окончания – он. В конце названия ставится цифра, указывающая положение в цепи атома углерода, с которым связан карбонильный кислород. Если разветвленность одинакова, то нумеруют с того конца цепи, к которому ближе расположена карбонильная группа.

Для некоторых кетонов распространены тривиальные названия, например ацетон.
Физические свойства. Простейшие кетоны являются бесцветными жидкостями, которые растворяются в воде. Кетоны обладают приятным запахом. Высшие кетоны – твердые вещества. Газообразных кетонов не бывает, так как уже простейший из них (ацетон) – жидкость. Многие химические свойства, характерные для альдегидов, проявляюся и у кетонов.
Химические свойства:
1) для кетонов характерны те же реакции замещения по α-С атому:

2) гидрирование кетонов в присутствии катализаторов приводит к образованию вторичных спиртов.
Кетоны окисляются значительно труднее альдегидов и только сильными окислителями. При окислении кетонов происходит разрыв (деструкция) углеродной цепи, и образуется смесь продуктов. Кетоны не вступают в реакцию «серебряного зеркала».
Получение:
1) кетоны образуются при окислении или каталитическом дегидрировании вторичных спиртов в присутствии медных катализаторов, например:

2) как и альдегиды, кетоны можно получить гидролизом дигалогенпроизводных алканов. Чтобы получился кетон, оба атома галогена в исходном соединении должны находиться при одном (не крайнем) атоме углерода:

3) кетоны образуются в результате присоединения воды к гомологам ацетилена в присутствии катализаторов – солей ртути (II), например:
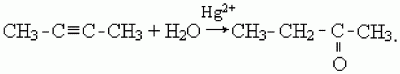
Альдегиды и кетоны содержат в молекуле одну и ту же карбонильную группу, обусловливающую много общих типических свойств. Поэтому имеется очень много общего и в способах получения и в химических реакциях обоих этих родственных классов веществ. Присутствие в альдегидах атома водорода, связанного с карбонильной группой, обусловливает ряд отличий этого класса веществ от кетонов.
Карбо́новые кисло́ты — класс органических соединений, молекулы которых содержат одну или несколько функциональных карбоксильных групп -COOH. Кислые свойства объясняются тем, что данная группа может сравнительно легко отщеплять протон. За редкими исключениями карбоновые кислоты являются слабыми. Например, у уксусной кислоты CH3COOH константа кислотности равна 1,75·10−5. Ди- и трикарбоновые кислоты более сильные, чем монокарбоновые.

![]()
Карбоновые кислоты
