
- •Непредельные (ненасыщенные) углеводороды
- •Гомологические ряды непредельных углеводородов и их особенности:
- •Сферы применения предельных углеводородов:
- •Для реакции присоединения характерны:
- •Общая формула кетонов —
- •Применение:
- •Нитро- и аминосоединения ароматического ряда и их производные
- •Химические свойства:
- •Жиры как питательные вещества.
- •Высокомолекулярные соединения (вмс)
№43 Характеристика переходных элементов – меди, хрома, железа по их положению в периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов.
Понятие переходный элемент обычно используется для обозначения любого из d- или f-элементов. Эти элементы занимают переходное положение между электроположительными s-элементами и электроотрицательными p-элементами. d-Элементы образуют три переходных ряда — в 4-м, 5-м и 6-м периодах соответственно. Первый переходный ряд включает 10 элементов, от скандия до цинка. Он характеризуется внутренней застройкой 3d-орбиталей. Хром и медь имеют на 4s-орбиталях всего по одному электрону. Дело в том, что полузаполненные или заполненные d-подоболочки обладают большей устойчивостью, чем частично заполненные. В атоме хрома на каждой из пяти 3d-орбиталей, образующих 3d-подоболочку, имеется по одному электрону. Такая подоболочка является полузаполненной. В атоме меди на каждой из пяти 3d-орбиталей находится по паре электронов (аналогичным образом объясняется аномалия серебра). Все d-элементы являются металлами. Большинство из них имеет характерный металлический блеск. По сравнению с s-металлами их прочность в целом значительно выше. В частности, для них характерны свойства: высокий предел прочности на разрыв; тягучесть; ковкость (их можно расплющить ударами в листы). Элемент Символ
d-элементы и их соединения обладают рядом характерных свойств: переменные состояния окисления; способность к образованию комплексных ионов; образование окрашенных соединений. d-Элементы характеризуются также более высокой плотностью по сравнению с другими металлами. Это объясняется сравнительно малыми радиусами их атомов. Атомные радиусы этих металлов мало изменяются в этом ряду. d-Элементы — хорошие проводники электрического тока, особенно те из них, в атомах которых имеется только один внешний s-электрон сверх полузаполненной или заполненной d-оболочки. Например, медь, . Химические свойства. Электроотрицательность и энергии ионизации металлов первого переходного ряда возрастают в направлении от хрома к цинку. Это означает, что металлические свойства элементов первого переходного ряда постепенно ослабевают в указанном направлении. Такое изменение их свойств проявляется и в последовательном возрастании окислительно-восстановительных потенциалов с переходом от отрицательных к положительным значениям. Хром — твердый голубовато-белый металл. При высоких температурах горит в кислороде с образованием Сr2О3, реагирует с парами воды
2
Сr
+ 3 Н2O
и с галогенами, образуя галогениды состава СrНаl3. Хром (так же, как алюминий) пассивируется холодными концентрированными Н2SО4 и НNО3. Однако при сильном нагревании эти растворяют хром: 2 Сr + 6 Н2SО4(конц) = Сr2(SО4)3 + 3 SО2↑ + 6 Н2О, Сr + 6 НNО3(конц) = Сr(NО3)3 + 3 NO2↑ + 3 Н2О. При обычной температуре хром растворяется в разбавленных кислотах (НСl, Н2SО4) с выделением водорода, образуя Сr2+. По своим свойствам соли Сr2+ похожи на соли Fе2+. Обрабатывая их растворы щелочами, получают желтый осадок гидроксида хрома (II): СrСl2 + 2 NaОН = Сr(ОН)2↓ + 2 NaСl. При прокаливании Сr(ОН)2 в отсутствие кислорода образуется оксид хрома (II) СrО. Соли Cr3+ сходны с аналогичными солями алюминия. При действии щелочей на соли Сr3+ выпадает студнеобразный осадок гидроксида хрома (III) зеленого цвета: Сr2(SО4)3 + 6 NaОН = 2 Сr(ОН)3↓ + 3 Na2SО4, обладающий амфотерными свойствами. Он растворяется как в кислотах с образованием солей хрома (III) 2 Сr(ОН)3 + 3 Н2SО4 = Сr2(SО4)3 + 6 Н2О, так и в щелочах с образованием тетрагидроксихромитов, т.е. солей, в которых Сr3+ входит в состав аниона: Сr(ОН)3 + КОН = К[Cr(ОН)4]. В результате прокаливания Сr(ОН)3 получают оксид Сr2О3 - зеленые кристаллы, нерастворимые в воде. Этот оксид получают также прокаливанием дихроматов калия и аммония:
При сплавлении Сr2О3 со щелочами, содой и кислыми солями получаются соединения Сr+3, растворимые в воде: Сr2О3 + 2 NaОН = 2 NaСrО2 + Н2О↑, Сr2О3 + Nа2СО3 = 2 NaСrО2 + СО2↑, Сr2О3 + 6 КНSО4 = Сr2(SО4)3 + 3 К2SО4 + 3 Н2О. Наиболее важными соединениями хрома в высшей степени окисления +6 являются оксид хрома (VI) СrО3, хромат (VI) калия К2СrО4 и дихромат (VI) калия К2Сr2О7. Оксид хрома (VI) — ангидрид хромовой Н2СrО4 и дихромовой Н2Сr2О7 кислот, представляет собой ярко-красные кристаллы, растворимые в воде. Он также реагирует со щелочами, образуя желтые хроматы СrО42-: СrО3 + 2 КОН = К2СrО4 + Н2О. В кислой среде ион CrO42- превращается в ион Сr2О72- . В щелочной среде эта реакция протекает в обратном направлении:
Металлическое железо получают восстановлением его оксидов; реагируя с водяным паром, оно образует смешанный оксид железа (II, III) FеO.Fе2О3: 3 Fе + 4 Н2О(пар) Fе3О4 + 4 Н2. На воздухе в присутствии влаги ржавеет: 4 Fе + 3 O2 + 6 Н2О = 4 Fе(ОН)3. С галогенами оно образует галогениды железа (III) 2 Fе + 3 Вr2 = 2 FеВr3, а взаимодействуя с соляной и разбавленной серной кислотами железа (II): Fе + Н2SО4 = FеSО4 + Н2↑. Концентрированные (НNО3, Н2SО4) пассивируют железо на холоде, однако растворяют его при нагревании: 2 Fе + 6 Н2SО4(конц) = Fе2(SО4)3 + 3 SО2↑ + 6 Н2О, Fе + 6 НNО3(конц) = Fе(NО3)3 + 3 NО2↑ + 3 Н2О. Растворимые соли железа в воде гидролизуются и дают кислую реакцию, поскольку железа (II) и (III) в воде не растворимы. Гидроксид железа (II) получают действием раствора щелочи на соли железа (II) без доступа воздуха: FеSО4 + 2 NaОН = Fе(ОН)2↓ + Na2SО4. Fе(ОН)2 — осадок белого цвета; в присутствии воздуха он быстро превращается в гидроксид железа (III) (бурый осадок): 4 Fе(ОН)2 + O2 + 2 Н2О = 4 Fе(ОН)3. Гидроксид железа (III), в отличие от Fе(ОН)2, амфотерен, при нагревании он способен растворяться в щелочах с образованием гексагидроферрата (III): Fе(ОН)3 + 3 КОН = К3[Fе(ОН)6] Это — один из анионных комплексов железа (III). Отметим еще две важные комплексные соли железа: гексацианоферрат (II) калия К4[Fе(СN)6] (желтая кровяная соль) и гексацианоферрат ( III) калия К3[Fе(СN)6] (красная кровяная соль), являющиеся реактивами для качественного определения ионов Fе3+ и Fe2+ соответственно. Добавление раствора гексацианоферрата (II) к растворам, в которых содержатся вызывает образование темно-синего осадка, часто называемого берлинской лазурью: 4 К4[Fе(СN)6] + 4 Fе3+ = 4 КFеIII[FеII(СN)6]↓ + 12 К+. (*) Такой же темно-синий осадок образуется при добавлении раствора гексацианоферрата (III) к растворам, содержащим ионы железа (II). В этом случае осадок называется турнбуллевой синью: 3 К3[Fе(СN)6] + 3 Fе2+ = 3 КFеII[FеIII(СN)6]↓ + 6 К+. (**) Установлено, что берлинская лазурь и турнбуллева синь — это одно и то же вещество, так как комплексы, образующиеся в реакциях (*) - (**) находятся между собой в равновесии: КFеIII[FеII(СN)6] КFeII[FеIII(СN)6]. Медь — довольно мягкий металл красно-желтого цвета, обладающий наименьшей активностью среди рассмотренных выше переходных металлов, которые вытесняют из растворов ее солей. Медь не реагирует с соляной и разбавленной серной кислотами и растворяется только в кислотах — окислителях: Сu + 2 Н2SО4(конц) = СuSО4 + SО2↑ + 2 Н2О, Сu + 4 НNO3(конц) = Сu(NО3)2 + 2 NО2↑ + 2 Н2О, 3 Cu + 8 НNО3(разб) = 3 Сu(NO3)2 + 2 NO↑ + 4 Н2О. Известны соединения меди со степенями окисления +1 и +2, из которых последние более устойчивы. Одновалентная медь образует либо нерастворимые Хлорид меди (I) растворяется в концентрированном растворе аммиака с образованием комплексной соли хлорида диамминмеди (I)[Сu(NН3)2]Сl; так же в аммиаке растворяется оксид меди (I): СuСl + 2 NН3 = [Сu(NН3)2]Сl, Сu2О + 4 NН3 + Н2О = 2[Сu(NН3)2]ОН. Ионы Сu2+ в водном растворе существуют в виде комплексов гексааквамеди (II) [Сu(Н2О)6]2+, придающих раствору сине-голубую окраску. При добавлении щелочи к такому раствору образуется голубой осадок гидратированного гидроксида меди (II): [Сu(Н2O)6]Сl2 + 2 NаОН = [Сu(ОН)2(Н2О)4]↓ + 2 NаСl + 2 Н2О. Полученный осадок, в свою очередь, растворяется в растворе аммиака, образуя ярко-синий комплекс. [Сu(ОН)2(Н2O)4] + 4 NН3 = [Сu(NН3)4(Н2О)2]2+ + 2 ОН- + 2 Н2О. Изменение окраски соединений меди при переходе из степени окисления +2 в Так, свежеосажденный Cu(ОН)2 голубого цвета восстанавливается альдегидами или углеводами (глюкозой) в желтый осадок гидроксида меди (I); последний даже при слабом нагревании распадается на воду и оранжевый оксид Сu2О. |
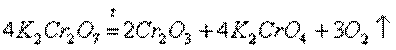
Элемент |
Символ |
Атомный номер |
Электронная конфигурация |
|||
Скандий |
Sc |
21 |
1s2 |
2s22p6 |
3s23p63d1 |
4s2 |
Титан |
Ti |
22 |
1s2 |
2s22p6 |
3s23p63d2 |
4s2 |
Ванадий |
V |
23 |
1s2 |
2s22p6 |
3s23p63d3 |
4s2 |
Хром |
Cr |
24 |
1s2 |
2s22p6 |
3s23p63d4 |
4s1 |
Марганец |
Mn |
25 |
1s2 |
2s22p6 |
3s23p63d5 |
4s2 |
Железо |
Fe |
26 |
1s2 |
2s22p6 |
3s23p63d6 |
4s2 |
Кобальт |
Co |
27 |
1s2 |
2s22p6 |
3s23p63d7 |
4s2 |
Никель |
Ni |
28 |
1s2 |
2s22p6 |
3s23p63d8 |
4s2 |
Медь |
Cu |
29 |
1s2 |
2s22p6 |
3s23p63d10 |
4s1 |
Цинк |
Zn |
30 |
1s2 |
2s22p6 |
3s23p63d10 |
4s2 |
Щелочная среда |
|
Кислая среда |
2 СrO2-4 + 2 H+ |
|
Cr2O2-7 + H2O |
|
|
|
№45 (нет физического и физико-химического анализа)
Титриметрический анализ (синоним объемный анализ) — метод количественного анализа, основанный на точечном измерении объемов веществ, вступивших в химическую реакцию.
Титриметрический анализ широко применяется в биохимических, клинических, санитарно-гигиенических и других лабораториях в экспериментальных исследованиях и для клинических анализов
Виды титрования
Прямое титрование-определяемое вещ-во в процессе титрования непосредственно реагирует с реагентом. А+В – продукт реакции
Обратное титрование-к раствору определяемого вещ-ва добавляют точно известное колич-во другого вещ-ва в избытке (титрант 1), не выступившее в реакцию колич-во титранта 1 оттитровывают титрантом 2. А+В1 – продукт реакции + В1 (ост.) В1+В2 – продукт реакции.
Косвенное титрование -к раствору определяемого вещества добавляют сначала заведомый избыток специального реагента и затем титруют один из продуктов реакции между анализируемым веществом и добавленным реагентом. А+Д – С; С+В – продукт реакции.
Гравиметрический анализ – называют метод количественного химического анализа, при котором о количестве элемента (вещ-ва) в исследуемой пробе судят по массе вещества, полученного в результате анализа.
Различают три группы методов проведения гравиметрического анализа — методы выделения, отгонки и методы осаждения.
Методы выделения.Эти методы основаны на выделении определяемого вещества в твердую фазу в элементарном виде. Например, при определении сульфата меди в образце, содержащем индифферентные примеси, навеску образца растворяют и осаждают образовавшиеся ионы меди в виде металла (Сu2++ H2®Cu0¯+ 2H+), который отфильтровывают, промывают, высушивают и взвешивают на аналитических весах. Измерив массу выделенной меди рассчитывают массу сульфата меди и его массовую долю в образце.
Методы отгонки. Эти методы основаны на измерении точной массы выделившихся в процессе анализа газообразных продуктов. Методы отгонки применяются в нескольких вариантах: а) определяемое вещество отгоняют из точной навески исследуемого образца и по уменьшению ее массы судят о содержании летучего компонента, например, таким способом определяют количество гигроскопической влаги в веществе и кристаллизационной воды в солях, высушивая навеску образца при определенной температуре до постоянной массы (см. разд.II, раб.5); б) определяемое вещество переводят химическим путем в летучее состояние и отгоняют, например, при анализе силикатов, содержащейся в них диоксид кремния (SiO2) действием плавиковой кислоты (HF) переводят в летучий продукт – тетрафторид кремния (SiF4), который отгоняют из образца и по убыли массы навески рассчитывают содержание кремния; в) определяемое вещество переводят в летучее состояние, отгоняют и поглощают каким-либо поглотителем, по увеличению массы которого рассчитывают содержание компонента, например, при определении карбоната кальция в известняке выделяют CО2 (действием на СаСО3 кислоты или прокаливанием), пропускают его через газопоглотительную трубку с натронной известью или аскаритом, по увеличению массы трубки определяют массу поглощенного углекислого газа и рассчитывают массу и массовую долю карбоната кальция в анализируемом образце.
Методы осаждения. Эти методы основаны на довольно простой общей схеме определения, когда навеску анализируемого образца (mнав), содержащего определяемое вещество (В), переводят в раствор и добавляют избыток реагента-осадителя (А). Образовавшийся осадок (форма осаждения ВbАa) отфильтровывают, промывают, высушивают (прокаливают) до постоянной массы (весовая форма С) и взвешивают на аналитических весах:
Химические методы основаны на использовании количественно протекающих, различных по типу химических реакций: обменных, осадительных, окислительно-восстановительных и реакций комплексообразования. К химическим относятся гравиметрический и титриметрический (объемный) методы анализа.
№46
Строение углеводородов.
В природном газе и особенно в нефти содержится много углеводородов, сходных с метаном по строению и свойствам.
Предельные углеводороды (неразветвленного строения):
1) метан; 2) этан; 3) пропан; 4) бутан; 5) пентан; 6) гексан; 7) гептан; 8) октан; 9) нонан; 10) декан.
Для наименования всех предельных углеводородов принят суффикс – ан.
С увеличением молекулярной массы последовательно возрастают температуры плавления и кипения углеводородов.
Первые четыре вещества (С1 – С4) при обычных условиях – газы.
Все предельные углеводороды нерастворимы в воде, но могут растворяться в органических растворителях.
Общая формула углеводородов: СnH2n+2, где n – число атомов углерода в молекуле.
Химические свойства предельных углеводородов
1. Горение углеводородов на воздухе и выделение большого количества теплоты.
Продукты горения подтверждают наличие углерода и водорода в метане. Если поджечь газ, собранный в стеклянном цилиндре, то после прекращения горения стенки внутри цилиндра становятся влажными.
При добавлении в цилиндр известковой воды она становится мутной.
При горении метана образуются вода и оксид углерода (IV).
2. Смесь метана с кислородом или воздухом при поджигании может взрываться.
Наиболее сильный взрыв получается, если смешать метан с кислородом в объемном отношении 1:2. Оптимальное отношение объемов при взрыве метана с воздухом 1:10.
Взрыв меньшей силы может происходить и при некоторых других объемных отношениях газов.
Наиболее опасными являются смеси метана с воздухом в каменноугольных шахтах, заводских котельных, квартирах.
Для обеспечения безопасности работы в шахтах устанавливают автоматические приборы – анализаторы, сигнализирующие о появлении газа.
Горение углеводородов, которые имеют значительную молекулярную массу.
Парафин – это смесь твердых углеводородов.
Если поместить в фарфоровую чашечку кусочек парафина, расплавить и поджечь его, то при горении образуется много копоти.
Когда горят газообразные вещества, они хорошо смешиваются с воздухом и поэтому сгорают полностью.
При горении расплавленного парафина кислорода не хватает для сгорания всего углерода и углерод выделяется в свободном виде.
3. При сильном нагревании углеводороды разлагаются на простые вещества – углерод и водород.
Эти реакции могут служить подтверждением молекулярной формулы вещества: при разложении метана образуется двойной, а при разложении этана – тройной объем водорода по сравнению с объемом исходного газа (объем углерода как твердого вещества в расчет не принимается).
4. Реакция с галогенами (хлором).
Если смесь метана с хлором в закрытом стеклянном цилиндре выставить на рассеянный солнечный свет (при прямом солнечном освещении может произойти взрыв), то произойдет постепенное ослабление желто-зеленой окраски хлора при взаимодействии его с метаном.
Химическая реакция заключается в разрыве одних связей и образовании новых.
Атомы хлора имеют в наружном слое по одному неспаренному электрону, становятся свободными радикалами.
Когда атом-радикал, который обладает высокой химической активностью, сталкивается с молекулой метана, его электрон начинает взаимодействовать с электронным облаком атома водорода. Между этими атомами устанавливается ковалентная связь и образуется молекула хлороводорода.
Непредельные (ненасыщенные) углеводороды
Непредельные углеводороды – это углеводороды, в молекулах которых имеются атомы углерода, которые связаны между собой двойными или тройными связями.
Ненасыщенные углеводороды – это углеводороды, молекулы которых имеют меньшее число атомов водорода, чем насыщенные.
Особенности непредельных углеводородов:
1) первыми представителями гомологических рядов непредельных углеводородов являются этилен (с двойной связью) и ацетилен (с тройной связью);
2) двойная связь состоит из одной δ-связи и одной π-связи;
3) по своей природе π-связь резко отличается от δ-связи. Основные отличия π-связи от δ-связи:
а) π-связь менее прочная при перекрывании электронных облаков вне плоскости молекулы;
б) двойная связь изображается двумя одинаковыми черточками, но при этом учитывается их неравноценность;
4) тройная связь состоит из одной δ-связи и двух π-связей.
Особенность тройной связи ацетилена и его гомологов: из электронного строения видно, что кратные связи (двойные и тройные) сравнительно легко (легче, чем одинарные) разрываются при химическом взаимодействии.
Гомологические ряды непредельных углеводородов и их особенности:
1) соединения гомологического ряда этилена выражаются общей формулой СnН2n;
2) названия гомологов по рациональной номенклатуре производятся от названий соответствующих предельных углеводородов путем замены окончаний (-ан на – илен);
3) по заместительной номенклатуре названия этиленовых углеводородов производятся от названий предельных углеводородов при замене окончаний – ан на – ен (-ен – двойная связь).
Общее международное название этиленовых углеводородов – алкены.
Олефины – это непредельные углеводороды ряда этилена, которые содержат одну двойную связь;
4) гомологический ряд ацетилена выражается формулой СnН2n-2;
5) название ацетиленовых углеводородов по заместительной номенклатуре производятся от названий предельных углеводородов при замене окончаний – ан на – ин.
Алкины – это общее название ацетиленовых углеводородов по заместительной номенклатуре.
Важным источником получения этилена и его гомологов служат газообразные и жидкие продукты крекинга углеводородов нефти.
Крекинг – это процесс расщепления углеводородов с длинными цепями на молекулы меньшей длины.
При крекинге наряду с предельными углеводородами всегда получаются и непредельные, которые образуются при крекинге, а также получаются дегидрированием предельных углеводородов, содержащихся в попутных газах нефтедобычи.
Сферы применения предельных углеводородов:
1) метан в составе природного газа находит все более широкое применение в быту и на производстве;
2) пропан и бутан применяются в виде «сжиженного газа», особенно в тех местностях, где нет подвода природного газа;
3) жидкие углеводороды используются как горючее для двигателей внутреннего сгорания в автомашинах, самолетах;
4) метан как доступный углеводород в большей степени используется в качестве химического сырья;
5) реакция горения и разложения метана используется в производстве сажи, идущей на получение типографской краски и резиновых изделий из каучука;
6) высокая теплота сгорания углеводородов обусловливает использование их в качестве топлива;
7) метан – основной источник получения водорода в промышленности для синтеза аммиака и ряда органических соединений.
Наиболее распространенный способ получения водорода из метана – взаимодействие его с водяным паром.
Реакция хлорирования служит для получения хлорпроизводного метана.
Особенности хлорметана: 1) это газ; 2) это вещество, которое легко переходит в жидкое состояние; 3) это вещество, которое поглощает большое количество теплоты при последующем испарении.
Особенности дихлорметана, трихлорметана и тетрахлорметана: 1) это жидкости; 2) используются как растворители; 3) применяются для тушения огня (особенно когда нельзя использовать воду); 4) тяжелые негорючие газы этих веществ, которые образуются при испарении жидкости, быстро изолируют горящий предмет от кислорода воздуха.
Из гомологов метана при реакции изомеризации получаются углероводороды разветвленного строения.
Они используются в производстве каучуков и высококачественных сортов бензина.
Получение углеводородов: 1) предельные углеводороды в больших количествах содержатся в природном газе и нефти; 2) из природных источников их извлекают для использования в качестве топлива и химического сырья.
Особенности синтеза метана: 1) синтез метана показывает возможность перехода от простых веществ к органическим соединениям. Реакция идет при нагревании углерода с водородом в присутствии порошкообразного никеля в качестве катализатора; 2) синтез метана – реакция экзотермическая. Сильное нагревание не будет повышать выход продукта, равновесие сместится в сторону образования исходных веществ; 3) при слабом нагревании будет недостаточна скорость образования метана; 4) оптимальная температура синтеза метана примерно 500 °C; 5) для разложения метана необходима температура 1000 °C.
Альдегиды – это органические вещества, молекулы которых содержат карбонильную группу, которая связана по крайней мере с одним атомом водорода и углеводородным радикалом.
![]()
Химические свойства альдегидов обусловливаются наличием в их молекуле карбонильной группы. По месту двойной связи в молекуле карбонильной группы могут проходить реакции присоединения. Если, например, пары формальдегида вместе с водородом пропускать над нагретым никелевым катализатором, происходит присоединение водорода: формальдегид восстанавливается в метиловый спирт. Полярный характер двойной связи обусловливает и другие реакции альдегидов, например присоединение воды.
Особенности реакции присоединения воды: а) к углеродному атому карбонильной группы, который несет частичный положительный заряд, за счет электронной пары кислородного атома присоединяется гидроксильная группа; б) электронная пара π-связи переходит к атому кислорода карбонильной группы и к кислороду присоединяется протон;
