
Заполнение электронами энергетических уровней атомов
Сумма п + l |
п |
l |
Состояние |
Сумма п + 1 |
п |
l |
Состояние |
1 |
1 |
0 |
1s |
6 |
4 |
2 |
4d |
|
6 |
5 |
1 |
5p |
|||
2 |
2 |
0 |
2s |
6 |
6 |
0 |
6s |
3 |
2 |
1 |
2р |
7 |
4 |
3 |
4f |
3 |
3 |
0 |
3s |
7 |
5 |
2 |
5d |
|
7 |
6 |
1 |
6p |
|||
4 |
3 |
1 |
3р |
7 |
7 |
0 |
7s |
4 |
4 |
0 |
4s |
|
|||
|
8 |
5 |
3 |
5f |
|||
5 |
3 |
2 |
3d |
8 |
6 |
2 |
6d |
5 |
4 |
1 |
4р |
8 |
7 |
1 |
7р |
5 |
5 |
0 |
5s |
8 |
8 |
0 |
8s |
Пример 1. Учитывая описанные закономерности, рассмотрите состояние и распределение электронов по энергетическим уровням и орбиталям для атомов калия (Z = 19) и скандия (Z = 21).
Решение
1) Предшествующий калию в ПСХЭ элемент аргон (Z = 18) имеет следующее распределение электронов:
а) по уровням атома:
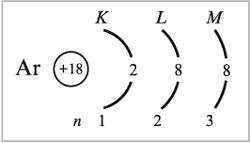
б) по орбиталям атома:

Электронная формула атома аргона:
![]()
Электронно-графическая формула атома аргона:
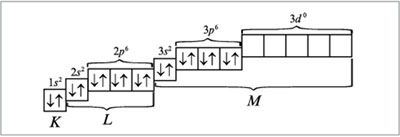
При распределении электронов в атоме К в соответствии с правилом Клечковского предпочтение отдается орбитали 4s (сумма квантовых чисел n + l равна: 4 + 0 = 4) по сравнению с орбиталью 3d (сумма квантовых чисел n + l равна: 3 + 2 = 5) как орбитали, имеющей минимальное значение n + l. Следовательно, для атома калия распределение электронов по орбиталям (электронно-графическая формула) имеет вид (см. п. 16 методических указаний):
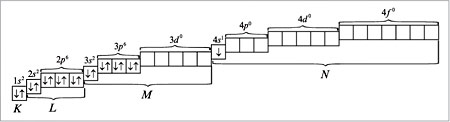
Калий относится к s-элементам со следующей электронной формулой (конфигурацией) атома:
![]()
Распределение электронов по энергетическим уровням для атома К изображено ниже:
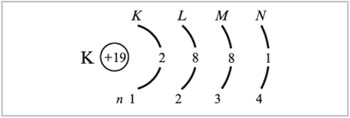
2) Предшествующий скандию в ПСХЭ элемент кальций (Z = 20) имеет следующее распределение электронов:
а) по уровням атома:
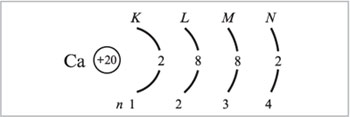
б) по орбиталям атома:
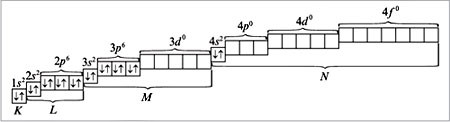
Электронная формула атома кальция:
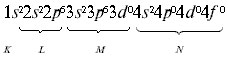
Из орбиталей 3d (n + l равно: 3 + 2 = 5) и 4p (n + l равно: 4 + 1 = 5) при распределении электронов в атоме скандия по орбиталям предпочтение следует отдать 3d-орбитали как имеющей минимальное значение n = 3 при одинаковых суммах квантовых чисел (n + l), равных пяти. Следовательно, скандий относится к d-элементам, и его атом характеризуется следующим распределением электронов по орбиталям:
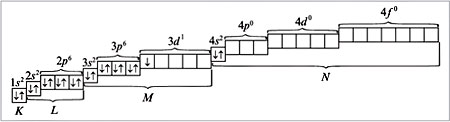
Электронная формула атома скандия:
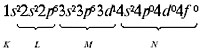
Распределение электронов по энергетическим уровням для атома Sc изображено ниже:
Пример 2. Дополните рисунок так, чтобы показать вид одной s-орбитали и трех р-орбиталей, ориентированных вдоль осей.

Число элементов в периоде таблицы Д.И.Менделеева определяется формулами:
а) для нечетных периодов:
Ln = (n + 1)2/2,
б) для четных периодов:
Ln = (n + 2)2/2,
где Ln – число элементов в периоде, n – номер периода.
Строгая периодичность расположения элементов в ПСХЭ Д.И.Менделеева полностью объясняется последовательным заполнением энергетических уровней атомов. Укреплению позиций периодического закона на основе закономерностей изменения электронной структуры атомов элементов, впервые предсказанных Н.Бором, способствовало открытие 72-го элемента. Еще не открытый тогда элемент химики искали среди минералов, содержащих редкоземельные элементы, исходя из неправильной предпосылки, что к лантаноидам следует отнести 15 элементов.
По аналогии с переходными элементами число лантаноидов (элементы № 58–71) должно быть равно разности между максимальными числами электронов на N и М энергетических уровнях (32 – 18 = 14), т. е. равно максимальному числу электронов на f-подуровне. Элемент с Z = 72 (гафний Hf) является аналогом циркония Zr и был обнаружен в циркониевых рудах.
Следующим важным выводом является вывод о периодичности заполнения электронами внешних энергетических уровней атомов, чем обусловлена периодичность изменения химических свойств элементов и их соединений.
Таблица
Электронные конфигурации атомов первых 20 элементов периодической системы
Атомный номер |
Обоз- начение |
Слой |
K |
L |
M |
N |
n |
1 |
2 |
3 |
4 |
||
l |
0 |
0, 1 |
0, 1, 2 |
0, 1, 2, 3 |
||
Подуровень |
1s |
2s, 2p |
3s, 3p, 3d |
4s, 4p, 4d, 4f |
||
Число электронов на данном подуровне |
||||||
1 2 |
H He |
|
1 2 |
|
|
|
3 4 5 6 7 8 9 10 |
Li Be B C N O F Ne |
|
2 2 2 2 2 2 2 2 |
1, 0 2, 0 2, 1 2, 2 2, 3 2, 4 2, 5 2, 6 |
|
|
11 12 13 14 15 16 17 18 |
Na Mg Al Si P S Cl Ar |
|
2 2 2 2 2 2 2 2 |
2, 6 2, 6 2, 6 2, 6 2, 6 2, 6 2, 6 2, 6 |
1, 0, 0 2, 0, 0 2, 1, 0 2, 2, 0 2, 3, 0 2, 4, 0 2, 5, 0 2, 6, 0 |
|
19 20 |
K Ca |
|
2 2 |
2, 6 2, 6 |
2, 6, 0 2, 6, 0 |
1, 0, 0, 0 2, 0, 0, 0 |
Так, второй период таблицы Д.И.Менделеева состоит из восьми элементов со следующими подуровнями:
|
При переходе от лития к неону заряд ядра атома постепенно увеличивается от Z = 3 до Z = 10, а значит, возрастают силы притяжения электронов к ядру, и в результате радиусы атомов этих элементов уменьшаются. Поэтому способность атома отдавать электроны (типично металлическое свойство), ярко выраженная у атома лития, постепенно ослабевает при переходе от лития к фтору. Последний является типичным неметаллом, т. е. элементом более, чем другие, способным присоединять электроны.
Начиная со следующего за неоном элемента (Na, Z = 11) электронные структуры атомов повторяются, и поэтому электронные конфигурации их внешних электронных оболочек обозначаются сходным образом (n – номер периода):
ns1 (Li, Na), ns2 (Be, Mg), ns2np1 (B, Al), ns2np2 (C, Si) и т. д.
В четвертом периоде таблицы Д.И.Менделеева появляются переходные элементы, принадлежащие побочным подгруппам.
Элементы, принадлежащие одной и той же подгруппе, имеют сходный характер расположения электронов на внешних электронных уровнях атомов. Например, атомы галогенов (главная подгруппа VII группы) все имеют электронную конфигурацию ns2np5, а атомам элементов побочной подгруппы той же группы свойственна электронная конфигурация (n – 1)s2(n – 1)p6(n – 1)d5ns2.
В чем заключается суть сходства и различия атомов элементов, принадлежащих разным подгруппам одной и той же группы таблицы Д.И.Менделеева? Свои выводы в дальнейшем сверьте с приложением 1 (П-24).
Численное значение валентности атома, определяемое числом образованных им ковалентных химических связей, отражает положение элемента в ПСХЭ Д.И.Менделеева. Во многих случаях валентность атома элемента в соединении численно равна номеру группы в ПСХЭ Д.И.Менделеева. Однако из этого правила существуют исключения. Например, у атома фосфора на внешнем (третьем, М) энергетическом уровне находятся три неспаренных электрона (3р-орбитали) и свободные валентные ячейки d-орбиталей. Следовательно, для атома фосфора характерно так называемое возбуждение электрона, связанное c распариванием электронной пары и переходом одного их образующихся неспаренных электронов на 3d-орбиталь. Для возбужденного состояния атома фосфора возможно образование пяти ковалентных связей, а для основного – только трех.
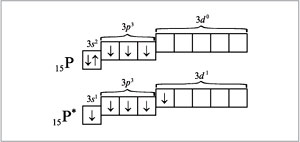
Для атома азота возбужденное состояние нетипично, поскольку в этом атоме на внешнем энергетическом уровне количество и состояние электронов такое же, как в атоме фосфора, но вакантных ячеек нет, и для завершения и устойчивости этого уровня недостает всего трех электронов.
