
Основные положения
Для описания движения атомов или частиц применяется классическая механика. Закон движения частиц находят при помощи аналитической механики.
Силы межатомного взаимодействия можно представить в форме классических потенциальных сил (как градиент потенциальной энергии системы).
Точное знание траекторий движения частиц системы на больших промежутках времени не является необходимым для получения результатов макроскопического (термодинамического) характера.
Наборы конфигураций, получаемые в ходе расчетов методом молекулярной динамики, распределены в соответствии с некоторой статистической функцией распределения, например отвечающей микроканоническому распределению.
Основное уравнение МКТ связывает макроскопические параметры (давление, объём, температура) газовой системы с микроскопическими (масса молекул, средняя скорость их движения).
Это уравнение связывает между собой макропараметр p состояния идеального газа и микропараметр (или ), характеризующий движение молекулы. Для вывода основного уравнения MKT рассмотрим одноатомный идеальный газ, находящийся в термодинамическом равновесии, т.е. в состоянии, в котором все макроскопические параметры остаются неизменными во времени и по всему объему.
![]()
Оно связывает макропараметр p с микропараметром (или ) и показывает, что понятие давления имеет смысл средней величины и неприменимо к отдельной молекуле.
Уравнение состояния газа Ван-дер-Ваальса — уравнение, связывающее основные термодинамические величины в модели газа Ван-дер-Ваальса
Термическим уравнением состояния (или, часто, просто уравнением состояния) называется связь между давлением, объёмом и температурой.
Для одного моля газа Ван-дер-Ваальса оно имеет вид
![]()
P— давление,
V— молярный объём,
t — абсолютная температура,
r — универсальная газовая постоянная.
Для молей газа Ван-дер-Ваальса уравнение состояния выглядит так:

Недостатки уравнения Ван-дер-Ваальса
1. Для реальных веществ
![]()
2. Для реальных веществ
![]() (скорее, 2b
(скорее, 2b
3. Уравнение Ван-дер-Ваальса расходится с экспериментом в области двухфазных состояний.
Изотермы Ван дер Вальса
Для пояснения характера изотерм преобразуем уравнение Ван-дер-Ваальса (61.2) к виду
![]()
Уравнение (62.1) при заданных р и Т является уравнением третьей степени относительно Vm; следовательно, оно может иметь либо три вещественных корня, либо один вещественный и два мнимых, причем физический смысл имеют лишь вещественные положительные корни. Поэтому первому случаю соответствуют изотермы при низких температурах (три значения объема газа V1, V2 и V3 отвечают (символ «m» для простоты опускаем) одному значению давления р1), второму случаю — изотермы при высоких температурах.
Рассматривая различные участки изотермы при T<Тк (рис. 90), видим, что на участках 1—3 и 5—7 при уменьшении объема Vm давление р возрастает, что естественно. На участке 3—5 сжатие вещества приводит к уменьшению давления; практика же показывает, что такие состояния в природе не осуществляются. Наличие участка 3—5 означает, что при постепенном изменении объема вещество не может оставаться все время в виде однородной среды; в некоторый момент должно наступить скачкообразное изменение состояния и распад вещества на две фазы. Таким образом, истинная изотерма будет иметь вид ломаной линии 7—6—2—1. Часть 6–7 отвечает газообразному состоянию, а часть 2–1 — жидкому. В состояниях, соответствующих горизонтальному участку изотермы 6—2, наблюдается равновесие жидкой и газообразной фаз вещества. Вещество в газообразном состоянии при температуре ниже критической называется паром, а пар, находящийся в равновесии со своей жидкостью, называется насыщенным.

Данные выводы, следующие из анализа уравнения Ван-дер-Ваальса, были подтверждены опытами ирландского ученого Т. Эндрюса (1813—1885), изучавшего изотермическое сжатие углекислого газа. Отличие экспериментальных (Эндрюс) и теоретических (Ван-дер-Ваальс) изотерм заключается в том, что превращению газа в жидкость в первом случае соответствуют горизонтальные участки, а во втором — волнообразные.
Критическая изотерма и закон соответственных состояний
Наличие критической точки на изотерме Ван–дер–Ваальса означает, что для каждой жидкости существует такая температура, выше которой вещество может существовать только в газообразном состоянии. К этому заключению пришел и Д.И. Менделеев в 1861 г. Он заметил, что при определенной температуре прекращалось поднятие жидкости в капиллярах, т.е. поверхностное натяжение обращалось в нуль. При той же температуре обращалась в нуль скрытая теплота парообразования. Такую температуру Менделеев назвал температурой абсолютного кипения. Выше этой температуры, согласно Менделееву, газ не может быть сконденсирован в жидкость никаким увеличением давления.
Критическую точку K мы определили как точку перегиба критической изотермы, в которой касательная к изотерме горизонтальна (рис. 7.5). Ее можно определить также как точку, в которую в пределе переходят горизонтальные участки изотерм при повышении температуры до критической. На этом основан способ определения критических параметров Pk, Vk, Тk, принадлежащий Эндрюсу. Строится система изотерм при различных температурах. Предельная изотерма, у которой горизонтальный участок LG (рис. 7.4) переходит в точку, будет критической изотермой, а указанная точка – критической точкой
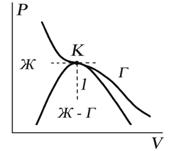
Закон соответственных состояний гласит, что все вещества подчиняются одному уравнению состояния, если это уравнение выразить через приведенные переменные. Этот закон является приближенным и позволяет достаточно просто оценивать свойства плотного газа или жидкости с точностью порядка 10—15%. Первоначально был сформулирован Ван дер Ваальсом в 1873 году.
![]()
где соответственно давление, молярный объем и температура
Соответственных состояний закон утверждает, что если для группы в-в совпадают две из трех приведенных переменных, то совпадает и третья переменная. Два в-ва считаются находящимися в соответственных состояниях, если для них т, p и f одинаковы.
В любой изолированной системе запас энергии остаётся постоянным.[2] Это — формулировка Дж. П. Джоуля (1842 г.).
Количество теплоты, полученное системой, идёт на изменение её внутренней энергии и совершение работы против внешних сил
Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе, то есть, оно зависит только от начального и конечного состояния системы и не зависит от способа, которым осуществляется этот переход. Это определение особенно важно для химической термодинамики[2] (ввиду сложности рассматриваемых процессов). Иными словами, внутренняя энергия является функцией состояния. В циклическом процессе внутренняя энергия не изменяется.
![]()
Изменение полной энергии системы в квазистатическом процессе равно количеству теплоты , сообщённому системе, в сумме с изменением энергии, связанной с количеством вещества при химическом потенциале , и работы [3], совершённой над системой внешними силами и полями, за вычетом работы , совершённой самой системой против внешних сил
![]()
Для элементарного количества теплоты , элементарной работы и малого приращения внутренней энергии первый закон термодинамики имеет вид:
![]()
Разделение работы на две части, одна из которых описывает работу, совершённую над системой, а вторая — работу, совершённую самой системой, подчёркивает, что эти работы могут быть совершены силами разной природы вследствие разных источников сил.
Первое начало термодинамики:
при изобарном процессе
![]()
при изохорном процессе ()
![]()
при изотермическом процессе
![]()
Для любого идеального газа справедливо соотношение Майера:
![]()
где — универсальная газовая постоянная, — молярная теплоёмкость при постоянном давлении, — молярная теплоёмкость при постоянном объёме.
Уравнение Майера вытекает из первого начала термодинамики, примененного к изобарному процессу в идеальном газе:
![]()
в рассматриваемом случае:
![]()
![]()
Очевидно, уравнение Майера показывает, что различие теплоёмкостей газа равно работе, совершаемой одним молем идеального газа при изменении его температуры на 1 K, и разъясняет смысл универсальной газовой постоянной — механический эквивалент теплоты.
Теплоёмкость тела (обычно обозначается латинской буквой C) — физическая величина, определяющая отношение бесконечно малого количества теплоты δQ, полученного телом, к соответствующему приращению его температуры δT:
![]()
